近日,第114届美国癌症研究协会(AACR)年会在美国佛罗里达州奥兰多举行。作为美国肿瘤界最为盛大的多学科会议,备受创新药研究机构、制药企业、投机机构关注。
在今年的AACR年会中,与ADC药物相关详情信息多达数百条。
ADC龙头第一三共公布了其靶向HER3的ADC产品Patritumab deruxtecan (HER3-DXd)最新研究进展;阿斯利康也披露了AZD9592 (双特异性ADC)、AZD5335 (FRα ADC)等多款药物研究动态。
中国也有众多药企携ADC项目亮相本届AACR年会。恒瑞医药公布了SHR-A1811 (HER2 ADC)、SHR-A1921 (Trop2 ADC)的最新临床试验数据;百奥赛图公布了YH013 (EGFR/Met ADC)、BCG022 (HER3/Met ADC)、BCG033 (PTK7/TROP2 ADC)、BSA01 (EGFR/MUC1 ADC)等药物的研究动态;映恩生物公布了DB1310 (Her3 ADC)、DB1303 (HER2 ADC)最新进展…
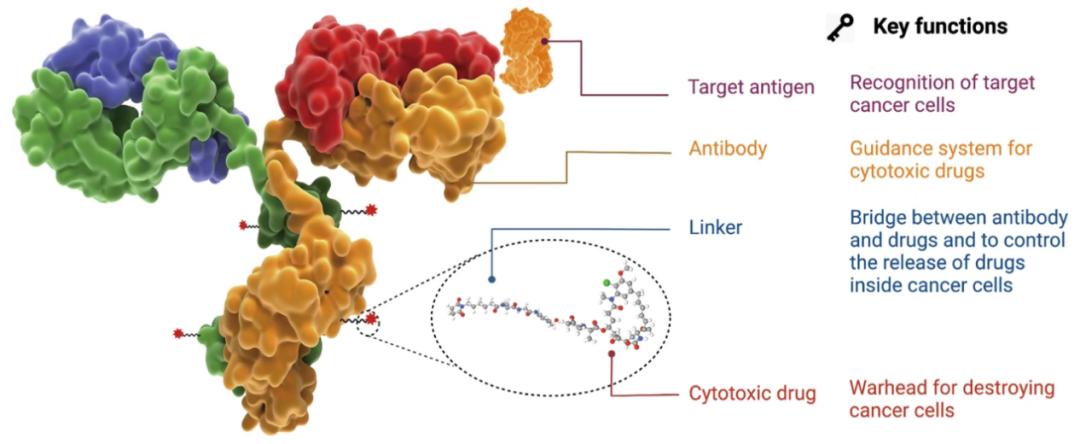
图片来源:参考资料
ADC进化史
早在1913年,诺奖得主德国科学家保罗·埃尔利希 Paul Ehrlich 首次提出“Magic bullets”(魔法子弹)设想:将毒素(子弹头)安装在能精准瞄准癌细胞的载体上,从而实现不伤害正常细胞的前提下精准杀死癌细胞。
随着单克隆抗体技术、抗体人源化技术的诞生和进步,在2000年,FDA批准了辉瑞研发的ADC药物Mylotarg®,终于将这一设想化为现实。
此后,2011年第二款ADC药物维布妥昔单抗上市以来,ADC药物才真正进入了快车道。截至目前,全球ADC药物获批数量已增加至16款。
从药物组成和技术特点来看,ADC药物可细分为三代。

图片来源:参考资料
第一代ADC
在早期研究阶段,ADC主要由传统的化疗药物通过不可切割的linker与小鼠衍生的抗体结合而成,如BR96-doxorubincin。这些ADC的药效相较于游离的细胞毒药物没有显著改善,并且具有显著的免疫原性。
为了改善这些缺点,后续研究人员选用效力更强的细胞毒药物与人源mAbs相结合,大大提高了ADC药物的疗效与安全性,从而使第一代ADC药物获得市场批准,包括gemtuzumab ozogamicin和inotuzumab ozogamicin。
第一代ADC的主要缺陷在于:
Linker不稳定。一代ADC所采用的酸不稳定linker在体内其他酸性环境中可能会裂解,甚至在血液循环(pH 7.4, 37 °C)中也会缓慢裂解,导致细胞毒物的不可控释放和意外的脱靶毒性。
采用IgG4抗体分子。
细胞毒素疏水聚集。一代ADC搭载了强效细胞毒性的卡利卡霉素。卡利卡霉素是疏水性的,容易引起抗体聚集,从而导致如半衰期短、清除快、免疫原性等缺陷。
共轭技术低下导致DAR值不稳定,异质性严重。DAR(0-8)药物-抗体比,代表了有多少个细胞毒素附着在抗体上。第一代ADC的共轭是基于通过赖氨酸和半胱氨酸残基的随机共轭,从而产生DAR不同的高度异质混合物。不一致的DAR会对ADC药物的药动学和药效学(PK/PD)参数和治疗指数产生较大影响。因此,第一代ADC表现出窄治疗窗口,需要进一步改进。
第二代ADC
第二代ADC药物brentuximab vedotin和ado-trastuzumab emtansine经过了抗体,linker和细胞毒素三个组成部分的全面优化。
使用IgG1 同种型 mAb。与IgG4相比,IgG1更适合与小分子有效载荷进行生物共轭,并具有较高的癌细胞靶向能力。
更有效的细胞毒性药物。如auristatins和mytansinoids,其水溶性和偶联效率都有所提高,更多的细胞毒素可以加载到抗体上,而不会引起抗体的聚集。
Linker的稳定性提升,并引入两种不同的连接子(可切割以及不可切割),以实现更好的血浆稳定性和均匀的DAR分布。
以上改变使二代ADC具有更好的临床疗效和安全性,但是脱靶效应,较窄的治疗窗口,以及高DAR药物(大于6)的聚集和快速清除问题仍有待解决。
第三代ADC
第三代ADC代表药物polatuzumab vedotin, enfortumab vedotin和fam-trastuzumab deruxtecan等等。她们在共轭技术,抗体和细胞毒素的选择上都有显著的进步。
位点特异性共轭技术的产生,带来了同质的理想数量的DAR(2或4)。具有一致的DARs的ADCs显示出较少的脱靶毒性和较好的药代动力学效率。
使用了完全人源化的抗体而不是嵌合抗体,减少免疫原性。此外,抗原结合片段(Fabs)正在被开发,可以取代一些候选ADC中完整的mAbs,因为Fabs在全身循环中更稳定,并且更容易被癌细胞内化。
采用更加强力的细胞毒素,如PBD、tubulysin和具有新机制的免疫调节剂。
新的共轭偶联平台,更多的亲水linker(如PEG化)。亲水linker可以避免对免疫系统的干扰,改善在血液循环中的保留时间,还可以平衡某些细胞毒性有效载荷(如PBD)的高度疏水性
总的来说,三代ADC总体的差别在于其四大技术要素和众多性能指标的不同,ADC 药物演化的总体思路可以总结为:
抗体方面,从鼠源抗体、低修饰程度的抗体演化到全人源抗体、修饰程度高的抗体。
连接子方面,从低稳定性连接子演化到高稳定性水性连接子。
毒素方面,逐渐从低毒性毒素演化到高毒性毒素,并且更多的创新机制毒素不断出现。
偶联技术方面,从第三代 ADC 开始定点偶联技术逐渐成熟,越来越多新型ADC药物开始使用定点偶联技术
在不断更新迭代中,ADC药物的治疗窗口扩充明显,拥有了较低的毒性和较高的抗癌活性,以及较高的稳定性,在脚踏实地的技术进步带动下,离最初的设想越来越近了。
然而,在抗癌ADC的开发和使用方面仍然存在许多挑战,包括药代动力学的复杂性、不可避免的副作用、肿瘤靶向性和有效载荷释放的不足,以及药物耐药性等等,想要精准杀伤的愿望依旧未能完美实现。
新一代ADC药物的机遇与挑战
截至2023年3月,全球ADC药物获批数量已增至16款,其中2019年至今的3年多时间里新增了9款。目前,全球共计约有650余款活跃状态的传统ADC药物,其中近200余款产品处于不同的临床研究阶段。据业内人士预测,ADC更是未来5年内不可多得的、能延续高增长态势的重磅药物,能获得较高的市场溢价,在肿瘤药领域成为PD-1的接棒产品。
鉴于已上市和在研靶点的高度同质化,ADC赛道的内卷已经无可避免。新一代ADC势必要开辟新的疆土:
选择更易内化和降解,具有更高的泛素化水平的突变型蛋白抗体
选择更多可能性的双抗载体
选择搭载多种细胞毒素,减少抗药性增强疗效
选择分子量较小的多肽片段替代mAbs,从而提高渗透效率和有效载荷对肿瘤组织的输送
开发非内化型抗体ADC,跳过内化难题,在肿瘤微环境中释放,然后扩散到癌细胞内,导致细胞死亡
不再选择搭载细胞毒素,而是开始发现更多的靶向药物和免疫药物,如ADC+PD1(4月3日默沙东与Seagen宣布,Keytruda、Padcev联合疗法获FDA加速批准)
……
学术界和工业界数十年的努力已经成功开发了各种ADC疗法,使数以万计的癌症患者受益。。作为一个肿瘤药物领域新的风口,ADC药物已经成熟的生物学模型和踏实的技术工艺回报比引得大中小企业纷纷入局。希望在百花齐放的竞争环境里,可以卷出ADC更优秀的未来。
参考资料:
Antibody drug conjugate: the "biological missile" for targeted cancer therapy

责任编辑:琉璃
声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。
声明:本文内容由平台创作者发布,内容仅代表作者本人观点;如内容涉及违法、侵权等情形,请及时联系工作人员处理!工作人员微信:pckt6842。



