简介:2023年版GMP对微生物实验室管理进行了较全面的论述,其主要内容未第12章。本问主要涉及第12章的相关法规要求、技术要求和背景介绍。其中技术要求部分提及的微生物检验相关指南和药典等内容值得参考(在第二部分技术要求领取)。相关内容均可在博普智库资源库里寻找。
2023年GMP指南 质量控制实验室 部分(仅供参考,请勿下载)。
GMP指南2023-质量控制实验室(仅供参考不可下载,请购买官方正版)_1-100页
一、法规要求
1.药品生产质量管理规范(2010修订)
1.1第四章 厂房与设施 第四节 质量控制区
第六十三条 质量控制实验室通常应当与生产区分开。生物检定、微生物和放射性同位素的实验室还应当彼此分开。
第六十六条 处理生物样品或放射性样品等特殊物品的实验室应当符合国家的有关要求。
该部分主要体现在12.2设施和环境条件和12.4菌种管理。
1.2第十章 质量控制与质量保证 第一节 质量控制实验室管理
第二百一十九条 质量控制实验室的检验人员至少应当具有相关专业中专或高中以上学历,并经过与所从事的检验操作相关的实践培训且通过考核。
在12.1人员资质和培训要求下的“微生物操作岗需培训的知识和技能清单示例”与该条款关系较大,需要认真研究。
第二百二十一条 质量控制实验室的文件应当符合第八章的原则,并符合下列要求:
(三)宜采用便于趋势分析的方法保存某些数据(如检验数据、环境监测数据、制药用水的微生物监测数据);
关于数据的统计分析和趋势分析这点在理论知识和分析技能部分具有明确提及,但第十二章并未对该部分进行指导。第十三章13.4.6 环境监测数据管理中建议使用可追踪的电子系统记录环境检测数据等相关细节可以参考。其次就是本册第十一章 原始数据的管理 。
第二百二十六条 试剂、试液、培养基和检定菌的管理应当至少符合以下要求:
(一)试剂和培养基应当从可靠的供应商处采购,必要时应当对供应商进行评估;
(二)应当有接收试剂、试液、培养基的记录,必要时,应当在试剂、试液、培养基的容器上标注接收日期;
(三)应当按照相关规定或使用说明配制、贮存和使用试剂、试液和培养基。特殊情况下,在接收或使用前,还应当对试剂进行鉴别或其他检验;
(四)试液和已配制的培养基应当标注配制批号、配制日期和配制人员姓名,并有配制(包括灭菌)记录。不稳定的试剂、试液和培养基应当标注有效期及特殊贮存条件。标准液、滴定液还应当标注最后一次标化的日期和校正因子,并有标化记录;
(五)配制的培养基应当进行适用性检查,并有相关记录。应当有培养基使用记录;
(六)应当有检验所需的各种检定菌,并建立检定菌保存、传代、使用、销毁的操作规程和相应记录;
(七)检定菌应当有适当的标识,内容至少包括菌种名称、编号、代次、传代日期、传代操作人;
(八)检定菌应当按照规定的条件贮存,贮存的方式和时间不应当对检定菌的生长特性有不利影响。
该部分在指南里的主要体现是供应商管理,具体内容主要是12.4菌种管理、12.5培养基、12.6生物指示剂的管理。
2.药品生产质量管理规范(2010修订) 无菌药品附录
第十四章 质量控制
第八十条 无菌检查的取样计划应当根据风险评估结果制定,样品应当包括微生物污染风险最大的产品。无菌检查样品的取样至少应当符合以下要求:
(一)无菌灌装产品的样品必须包括最初、最终灌装的产品以及灌装过程中发生较大偏差后的产品;
(二)最终灭菌产品应当从可能的灭菌冷点处取样;
(三)同一批产品经多个灭菌设备或同一灭菌设备分次灭菌的,样品应当从各个/次灭菌设备中抽取。
该部分详见12.7.4无菌检查法。
二、技术要求
该部分涉及的内容主要是实验室管理(12.1-12.6)和12.7实验分类、12.8微生物数据偏差调查和12.9微生物鉴定。存在疑问时可以参考相关技术要求。附图标红部分的内容时接触较少的国外法规,建议了解其原则。
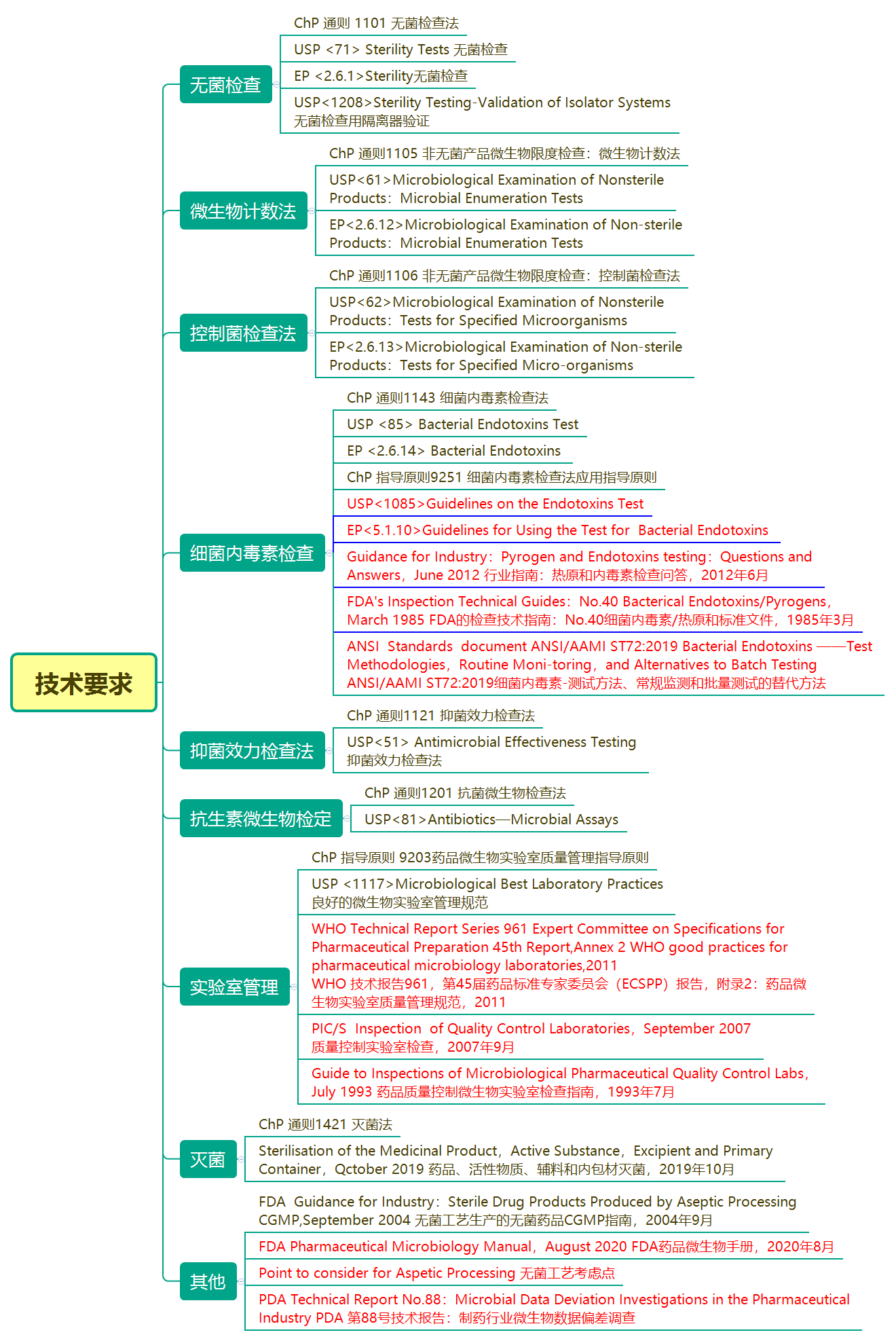
博普智库链接如下:
USP<1085>Guidelines on the Endotoxins Test
欧洲药典 EP 10.0-10.7 全集-2020_10th_Edition_Supplement_10.1_E
欧洲药典 EP 10.0-10.7 全集-2020_10th_Edition_Supplement_10.2_E
PDA TR88 制药行业中的微生物偏差调查
Guidance for Industry:Pyrogen and Endotoxins testing:Questions and Answers
WHO Technical Report Series 961 Expert Committee on Specifications for Pharmaceutical Preparation 45th Report,Annex 2 WHO good practices for pharmaceutical microbiology laboratories,2011
PIC/S Inspection of Quality Control Laboratories
Guide to Inspections of Microbiological Pharmaceutical Quality Control Labs,July 1993 药品质量控制微生物实验室检查指南,1993年7月
Laboratory_Manual_And_Workbook_In_Microbiology
FDA微生物实验室手册
Point to consider for Aspetic Processing 无菌工艺考虑点
PDA TR90 中英版Contamination Control Strategy Development in Ph
三、背景介绍
除了强调微生物检验是与药品安全性相关的中药质量指标外,还强调了微生物检验结果受很多因素的影响,如样品中微生物可能分布不均匀、微生物检验方法的误差较大等。为保证检验结果的可靠性,必需使用经验证的检验方法并严格按照药品微生物实验室规范要求进行试验。
其次说明了抗生素微生物检定、细菌内毒素检查、抑菌效力检查虽不属于微生物检验范围,但大部分企业是放在微生物实验室进行管理,故第12章一并讨论。
该部分作为第一部分,接下来会对12章分节进行学习。

