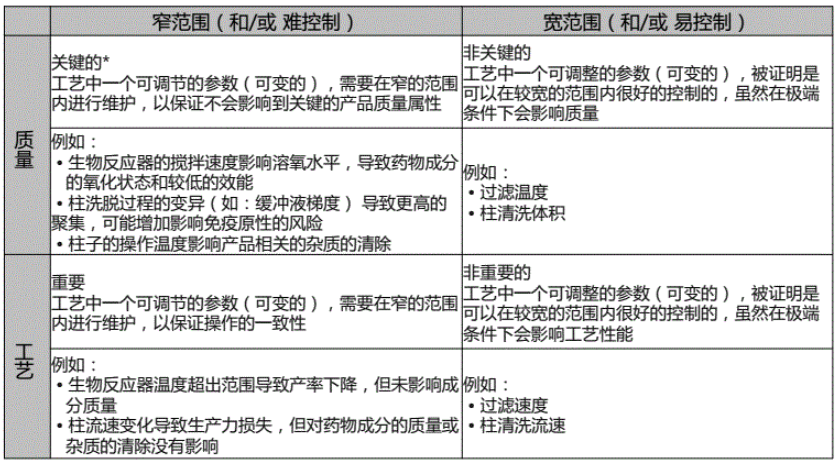
一、名词解释
1.目标产品质量概况(Quality Target Product Profile,QTPP):指理论上可以达到的、并将药品的安全性和有效性考虑在内的关于药品质量特性的前瞻性概述。
2.关键质量属性(Critical Quality Attribute,CQA):指产品的物理、化学、生物或微生物性质或特征,应在适当的限度、范围或分布之内,以确保预期的产品质量。
3.关键工艺参数(Critical Process Parameter,CPP):指其波动会影响到产品关键质量属性而应该被监测或控制的工艺参数,以确保能生产出预期质量的产品。
4.关键物料属性CMA:为达到目标产品质量,物料的物理、化学和生物学性质必须限定和控制在一定范围内,或在一定范围内分布。
二、关键工艺参数评定
药品生产依附于物料、生产工艺和生产设备,因此合适的物料属性、合理的生产工艺参数和工艺流程设计、性能稳定的生产设备是保证药品安全性、有效性和质量可控性不可或缺的基础条件。
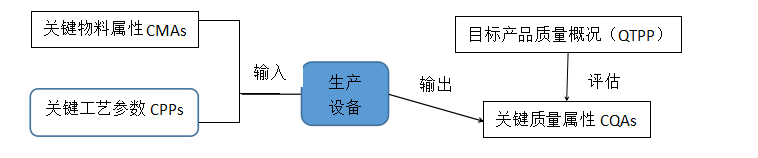
1.QTPP的制定:产品研发阶段,研究人员根据目标产品(即原研制剂、参比制剂)质量概况评估出产品关键质量属性,评估的核心要点也是从药品安全性、有效性两个维度进行评估。那么目标产品的质量概况一般有哪些呢?包括但不限于下表内容:
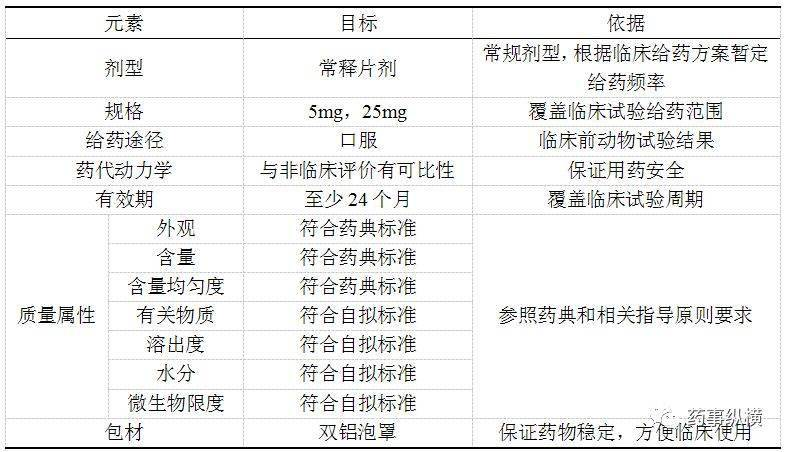
新药制剂早期的QTPP的制定来源主要是临床方案,服从项目开发的策略,并兼顾后续商业化开发。
早期研发的制剂基本的要求必须满足临床使用要求,临床试验是以研究为目的,为阐述科学问题,给药过程中可能会面对一些日常中不可能面对的问题,例如安慰剂、多剂量给药等;
项目开展之初就应当对整体的研发路径进行思考和规划,在整个新药研发的历程中,制剂的作用更多的是支撑技术,而非关键因素。一方面,其受到上游药物发现得到的化合物的理化性质和生物学性质的影响,另一方面,也受到下游临床试验的结果的制约。在整个药物研发的时间线中,问题在早期解决对于制剂的开发无疑是最为有益的,但时间成本却大大增加,此外新药研发过低的成功率也可能让这些早期投入归于沉没。新药研发一直在速度和风险之间的平衡。在早期制剂研发过程中,制剂开发做到何种程度,是必须要做的决策。
对于仅仅追求快速临床靶点验证而非快速商业化的项目来说,在早期选择简单的处方可能是更好的选择。但是如果以最终商业化为目标的项目开发,早期的制剂开发必然要兼顾后期的商业化开发,在早期制剂研发中投入少量时间做好处方前的评价工作,评估相应风险,制定好风险控制计划,为之前开发路径制定总体规划,可能会给后期的制剂开发节约更多时间。在初期的开发过程中,即使在早期是采用简单的制剂处方工艺开发,也不应该违背基本的制剂原理,在设计之初即加入对制剂商业化的考量。
1.CQA的制定:基于产品目标质量概况(QTPP),对产品的物理、化学、生物或微生物性质或特征,在适当的限度、范围或分布之内进行规定,以确保预期的产品质量。那么产品的关键质量属性有哪些?如何判定产品关键质量属性?以及如何对关键质量属性进行控制?包括但不限于下表内容:
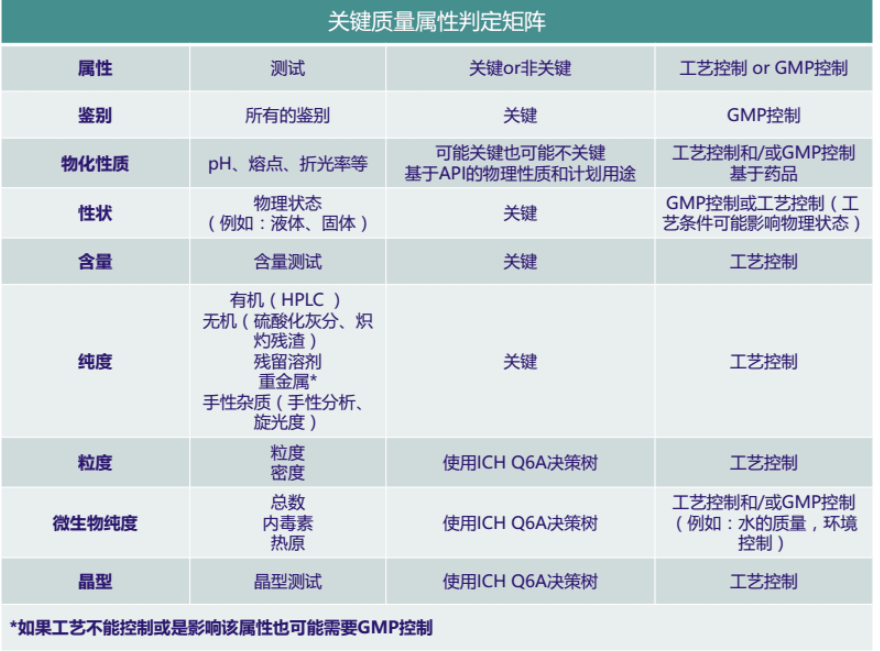
PDA第60号技术报告中曾指出,关键质量属性不等同于标准,二者也未必一一关联。标准是一系列检验列表,涉及分析规程及适当的可接受标准(如数值限度、范围,或其它检验的要求标准)。关键质量属性中识别的某些产品属性可由单项检验法来检测,可为其构筑一个单项检验标准(如,用单项检验:溶出度来评价作为关键质量属性的活性药用成分的溶解度、硬度、孔隙度)。若在工艺中可良好控制并持续获取某些关键质量属性(如,病毒清除不逐批检验),标准可不涵盖这些属性,而某些非关键属性可包括在标准中。另外,产品的关键质量属性(CQA)的确定是一个始于药品研发早期的持续性活动,需要随着产品和工艺知识的不断增加而更新。
2.CPP的制定:基于产品关键质量属性(QTPP),工艺参数中存在一部分参数的波动会影响到产品关键质量属性,因而需要被严格监测或控制的这部分参数可纳入关键工艺参数范畴进行监控,以确保能生产出预期质量的产品。那么如何根据产品质量属性评估产品关键工艺参数?可以从质量维度和工艺控制维度进行评估,即工艺参数(可变的)的变化是否会多产品关键质量属性产生影响、影响的程度有多大,可检测性有多大,参数变化的可能性有多高等维度对产品工艺参数进行评估,确认出关键工艺参数;一个可变的工艺参数在产品生产过程中的可控性和可操作性的情况也应当作为关键工艺参数评估的依据之一。包括但不限于下表内容: