
7 月 17 日,礼来在阿尔茨海默病协会国际会议(AAIC)上发布了 Aβ 单抗 Donanemab 的 III 期临床试验 TRAILBLAZER-ALZ 2 完整结果,同步发表于《美国医学会杂志》(JAMA)。AAIC 是国际痴呆科学研究领域规模最大、最具影响力的学术会议之一。
礼来表示,Q2 已经再次向 FDA 提交了 Donanemab 的新药上市申请(BLA),预计在年底前得到反馈。在美国之外,礼来也计划在全球其他市场陆续递交该药上市申请,大部分也将在年底前完成。

截图来自:礼来官网新闻
继 23 年初收到美国 FDA 发出的 CRL 之后,Donanemab 终于一扫阴霾,向全球市场再次进发。

越过坎坷,曙光将至
Donanemab 是一种靶向 N3pG (修饰化 β 淀粉样蛋白斑块)的在研抗体药物,这是淀粉样蛋白的一个亚型。通过与其结合,Donanemab 可促进淀粉样斑块的清除。
Donanemab 最初在 2021 年 10 月向 FDA 递交上市申请,基于 II 期临床试验 TRAILBLAZER-ALZ。这项注册临床数据在 2021 年 5 月发布在 NEJM,主要终点为患者从基线到 76 周时的 iDARs 评分变化。
当时,首款 Aβ 单抗 Aducanumab 刚刚在年中获批,引起行业轰动,礼来与卫材、罗氏一同,正是这一赛道中最受看好的选手之一。
2021 年下半年,礼来动作迅速,先是启动头对头研究正面对决 Aducanumab,再是紧随卫材递交加速批准 BLA,新建神经科学部门、任命前肿瘤学总裁 Anne White 担任负责人……
不过 Aducanumab 的商业化「死亡」,特别是 CMS 拒付,给几家领头企业浇了一盆冷水。23 年 1 月,FDA 又以患者数量不足的原因,发出了 CRL。如今,在 TRAILBLAZER-ALZ 2 这项 III 期研究成功之后,Donanemab 终于再度踏上了上市申报之路。
TRAILBLAZER-ALZ 2 研究(登记号:NCT04437511)是一项随机、双盲、安慰剂对照 III 期临床研究,旨在评估 Donanemab 在早期症状性阿尔茨海默病患者中的有效性和安全性。参与者根据受试者的 tau 蛋白水平进行分层,tau 蛋白是阿尔茨海默病进展的预测生物标志物。
临床试验时光轴
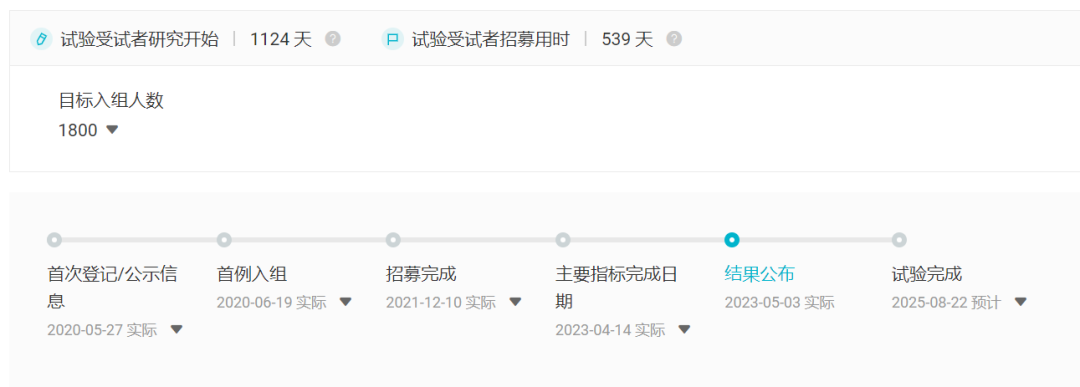
截图来自:Insight 数据库网页版(http://db.dxy.cn/)
正如此前所报道,在中低 tau 水平的受试者中(n=1182),主要终点指标 iADRS 显示 Donanemab 延缓了认知功能下降达 35% (p<0.0001),以及另一重要的关键指标 CDR-SB 评分显示 18 个月后 Donanemab 延缓了患者认知功能下降 36% (p <0.0001)
相较于其他同类药物,TRAILBLAZER-ALZ 2 研究纳入的患者疾病状态更深,这意味着相应患者群体范围也更广。
Aβ 单抗 III 期临床入组患者基线特征比较
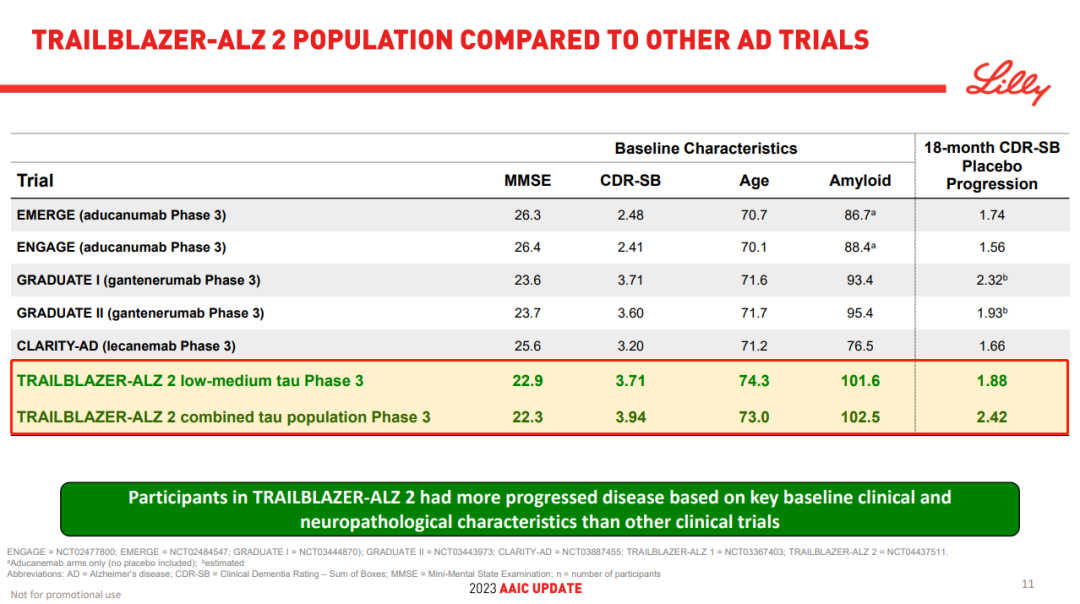
截图来自:礼来官网,下文如无特殊标注,均为同一来源
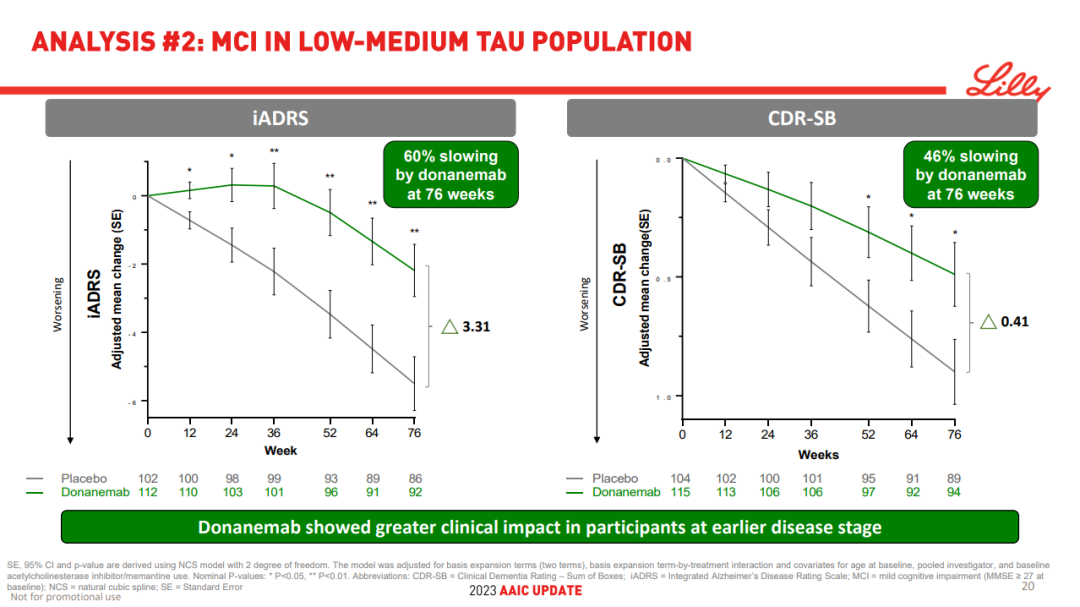
此外,基于临床阶段,对 tau 蛋白中低水平受试者进行的预先设定的亚群分析显示,donanemab 对处于疾病早期阶段的患者具有更大的获益:
在患有轻度认知障碍的受试者 (n=214) 中,Donanemab 使 iADRS 的下降减慢了 60%,CDR-SB 的下降减慢了 46%。对于阿尔茨海默病源性轻度痴呆患者 (n=534),Donanemab 对 iADRS 和 CDR-SB 的下降分别延缓了 30% 和 38%。
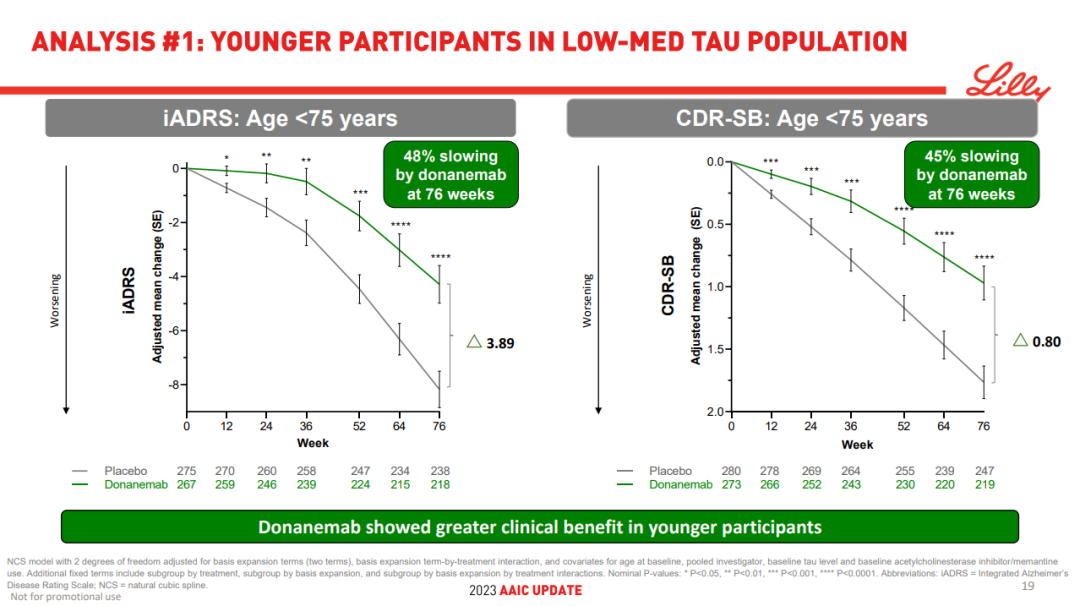
同样,基于年龄对 tau 蛋白中低水平受试者进行的事后亚组分析显示,donanemab 对 75 岁以下的患者具有更大的获益:
在 75 岁以下的受试者 (n=542) 中,donenamab 使 iADRS 的下降减缓了 48%,CDR-SB 的下降减缓了 45%。
在 75 岁或以上的受试者 (n=551) 中,donanemab 使 iADRS 的下降减缓了 25%,CDR-SB 的下降减缓了 29%。
其他亚组分析的结果均相似,包括携带或不携带 ApoE4 等位基因的受试者。
与安慰剂相比,donanemab 在整个试验过程中的总体治疗效果持续增长,其中最大的差异在 18 个月时出现。
据 Insight 数据库显示,礼来登记了 5 项 Donanemab III 期临床,即 TRAILBLAZER-2 ~ 6。
Donanemab 关键临床试验登记及进度
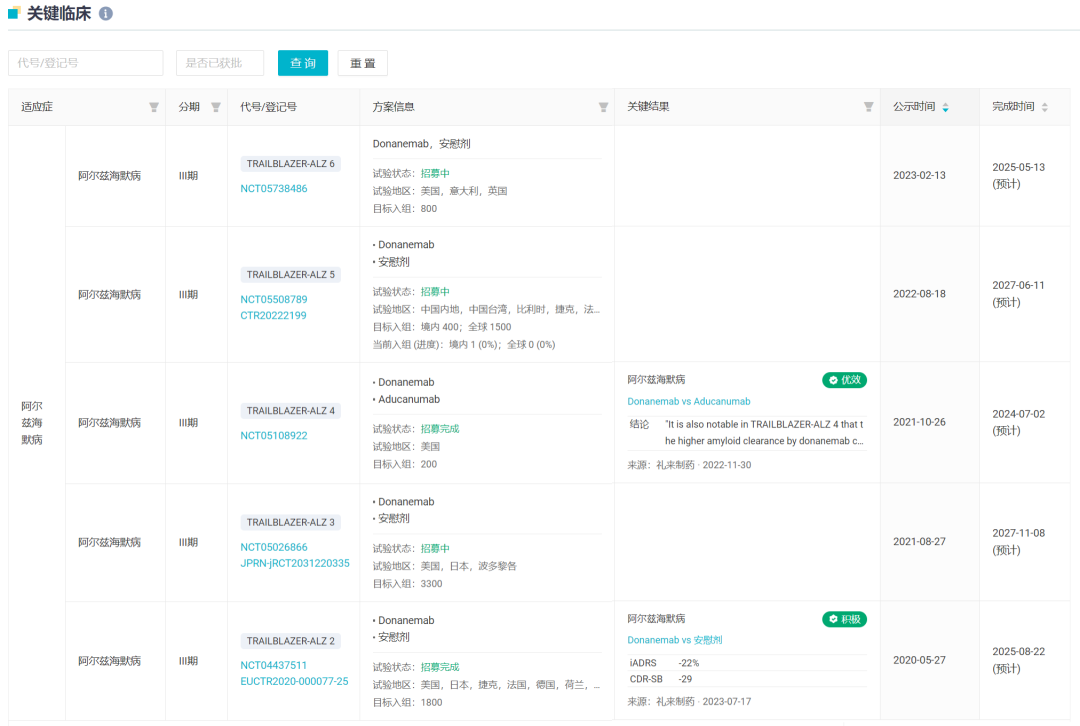
截图来自:Insight 数据库网页版
不过,尽管礼来新药耐受性良好,对于此类药物而言,淀粉样蛋白相关成像异常(ARIA)副作用仍需要重点关注。

阿尔茨海默病领域新希望
尽管 Aducanumab 是首个获得监管批准的 Aβ 单抗,但从实际意义来看,卫材与渤健共同开发的 Lecanemab 才是首位成功破局者。
2023 年 1 月 6 日,卫材/渤健的 Aβ 单抗 Lecanemab(商品名:Leqembi)在美国加速批准上市。1 月 23 日,Lecanemab 开出了首张处方,2 月 3 日,完成了首位患者输液。
而后在 7 月 6 日,FDA 在确认临床疗效后将 Lecanemab 由加速批准转为完全批准,成为 20 年来首款获 FDA 完全获批的阿尔茨海默病新药。
Lecanemab 上市申报 & 批准甘特图
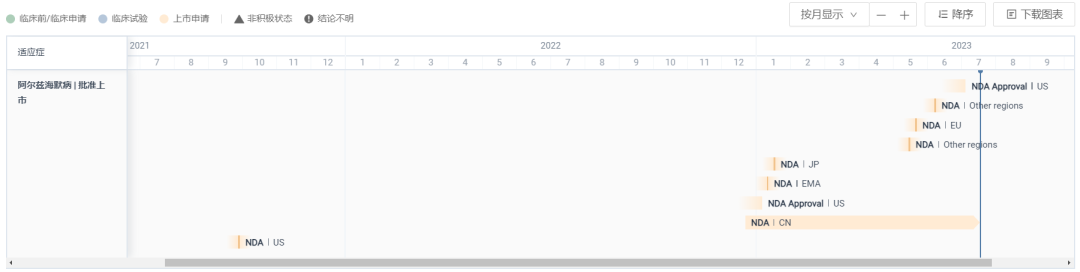
截图来自:Insight 数据库网页版
这一项目的最终决策权属于卫材,该公司是 Lecanemab 全球开发和监管提交的领导者;渤健将与卫材共同实现商业化推广。据 Evaluate 估计,Lecanemab 在 2028 年有望达到 30 亿美元的销售额。
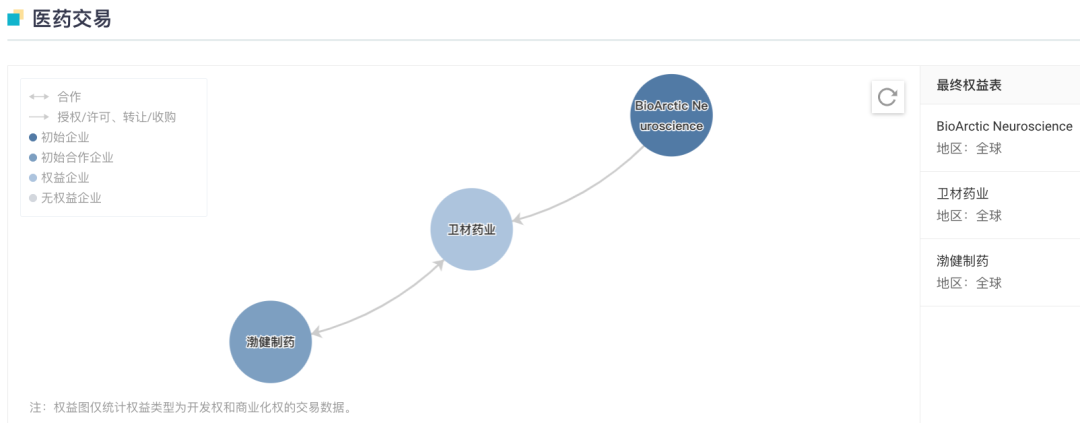
来自:Insight 数据库网页版
之所以能达成最终成功,不仅有赖于卫材与渤健在神经科学领域的不断耕耘,更来源于一项突破性结果:22 年 9 月 28 日,Lecanemab 确证性 III 期临床试验 Clarify AD 研究(试验登记号:NCT03887455)大获成功,引起行业轰动。
除 Aducanumab 的 EMERGE 研究之外,Clarify AD 是第一个在确证性 III 期临床中取得积极结果的同类药物,具有里程碑意义,其结果在同年在礼来取得同样成功之后,第 2 位重磅玩家眼看即将正式入局,阿尔茨海默病在近二十年的新药空白之后,终于迎来多款上市药物。
详情可跳转阅读 Insight 往期报道 >> 卫材 Lecanemab 验证性 III 期 Clarity-AD 全部结果公布( 卫材 Lecanemab 验证性 III 期 Clarity-AD 全部结果公布)
卫材 Lecanemab 验证性 III 期 Clarity-AD 全部结果公布)
III 期临床试验 Clarity AD 结果 @Insight 数据库

截图来自:Insight 数据库网页版
据 Insight 数据库显示,当前阿尔茨海默病治疗药物的研发,仍在高峰期。不过目前主要参与者仍是海外药企,这也与其投入高、研发难的特征有关。但对于这一患者群体极广、治疗需求极迫切的领域而言,一旦取得成功,无疑意味着优异的市场前景,药企和患者将实现「双赢」。
从国内维度来看,卫材/渤健的 Lecanemab 已经在上市申请中,有望年内获批上市;礼来的 Donanemab 也预计在年内申报上市。恒瑞是唯一开发 Aβ 单抗的国内企业,在本次 AAIC 会议中,也公布了 I 期临床初步数据,稳稳向前推进。
处于积极状态的阿尔茨海默病新药各阶段进展趋势
*仅统计首次进展至该阶段的药物数量
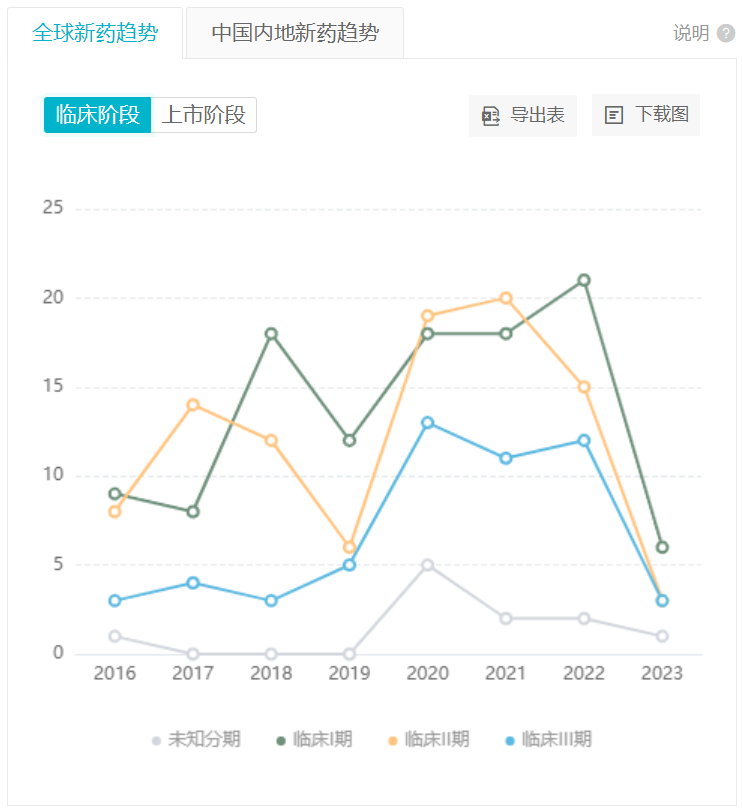
截图来自:Insight 数据库网页版
题图来源:企业 Logo
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
编辑:加一
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
点击卡片进入 Insight 小程序
国内审评进度、全球新药开发…
随时随地查!

多样化功能、可溯源数据……
Insight 数据库网页版等你体验

点击免费获取,立刻解锁!

声明:本文内容由平台创作者发布,内容仅代表作者本人观点;如内容涉及违法、侵权等情形,请及时联系工作人员处理!工作人员微信:pckt6842。



