说起β淀粉样蛋白,最近可谓是好消息连连,先是备受期待的Lecanemab(BAN2401)转为正式获批( Lecanemab(BAN2401)转为正式获批)Donanemab的精彩3期临床研究结果阿尔茨海默病(AD)新药了。
Lecanemab(BAN2401)转为正式获批)Donanemab的精彩3期临床研究结果阿尔茨海默病(AD)新药了。
如此繁荣景象,和几年前时不时就跳出一个新闻宣布新药开发失败真不可同日而语。
当然,这也不是说从此以后Aβ药物就前途一片光明,关于Aβ在AD病理中的作用,我们还有很多的不了解,Aβ药物研究此前存在的问题今后也依然不会消失,彻底搞清上下游机制,才是解决难题的关键点。
近期,首都医科大学宣武医院宋伟宏团队在《信号转导与靶向治疗(STTT)》杂志发表综述文章,系统性地讨论了基于Aβ的AD疗法所面临的挑战,文内还捋顺了过去30年来淀粉样蛋白级联假说的演变,非常值得一读。文章的通讯作者为宋伟宏教授和张韵副教授。

1984年,Glenner和Wong发现Aβ是AD病理表现中淀粉样斑块的核心组分,自此,Aβ就站在了AD研究舞台的最中央,认为Aβ为AD进展最主要驱动力的淀粉样蛋白级联假说也成为了AD发病机制最受认可的理论。
首先让我们来回顾一下Aβ到底是怎么回事吧。
Aβ由淀粉样蛋白前体蛋白(APP)裂解而成。在正常情况下,APP通过非淀粉样蛋白生成途径完成一系列切割,但是在AD中,该过程更倾向于通过淀粉样蛋白生成途径进行,详细过程可以参考下图,其中关键的两个酶是BACE1和γ分泌酶。
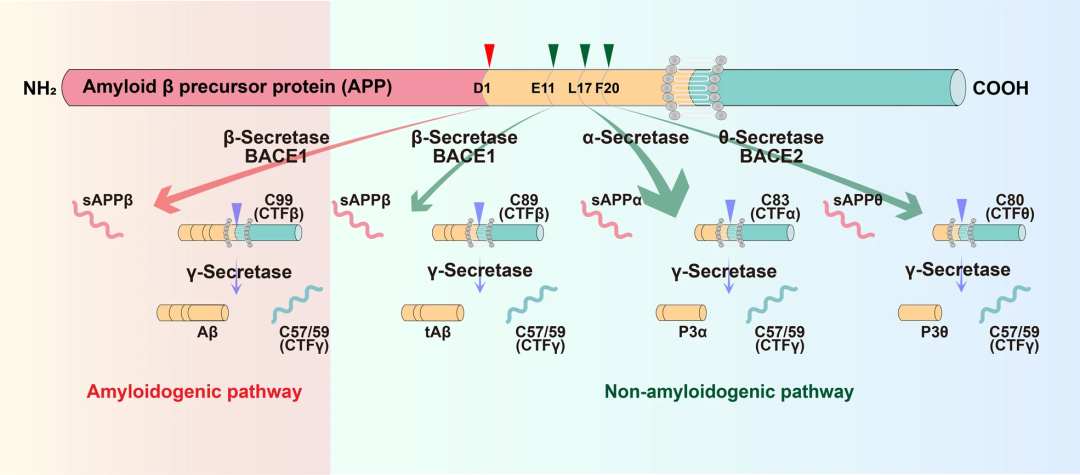
Aβ的生成过程
有丰富的遗传学证据支持,Aβ就是AD中的那个大魔王。
唐氏综合征(DS)患者由于3条21号染色体而具有额外的APP基因,他们会表现出典型的AD神经病理学,包括淀粉样斑块和神经纤维缠结;APP、早老素1/2(PSEN1/2)基因的突变会增加Aβ的产生,从而提升Aβ42/Aβ40、促进斑块形成,它们也是常染色体显性遗传早发性家族性AD(FAD)的病因;冰岛人群中发现的APP突变减少了Aβ的产生,因此具有对AD的保护作用;迟发性散发性AD(SAD)的诸多风险因素被认为与Aβ形成和清除有关……
不论怎么看,Aβ在AD进展中都有着至关重要的作用。
1992年,Hardy和Higgins提出了淀粉样蛋白级联假说,假设大脑中的Aβ沉积是AD发病的起点,导致随后的tau缠结、神经元丢失/功能障碍以及认知下降。这一假说在随后的漫长年月中不断得到新的证据补充,并成为AD病理研究的中流砥柱。
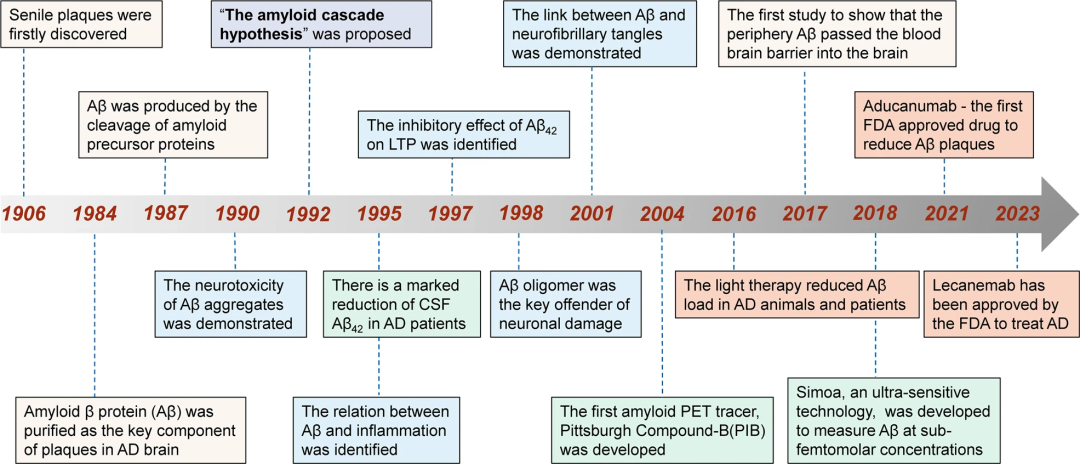
淀粉样蛋白级联假说的里程碑事件
黄框:主要研究成果;蓝框:Aβ毒理研究;绿框:诊断( 诊断)应用;橙框:重要的AD抗Aβ疗法
诊断)应用;橙框:重要的AD抗Aβ疗法
随着新证据的不断出现,我们对“究竟到底什么在毒害神经元”这一问题的认知改变是最大的。
Aβ以可溶性单体形式分泌,单体随后经过一系列复杂的交联转变为寡聚体、原纤维等聚集体,并最终形成斑块。起初,研究重点都关注于大的不溶性Aβ原纤维,但近年来的研究结果显示,Aβ低聚物才是真的“毒辣”。
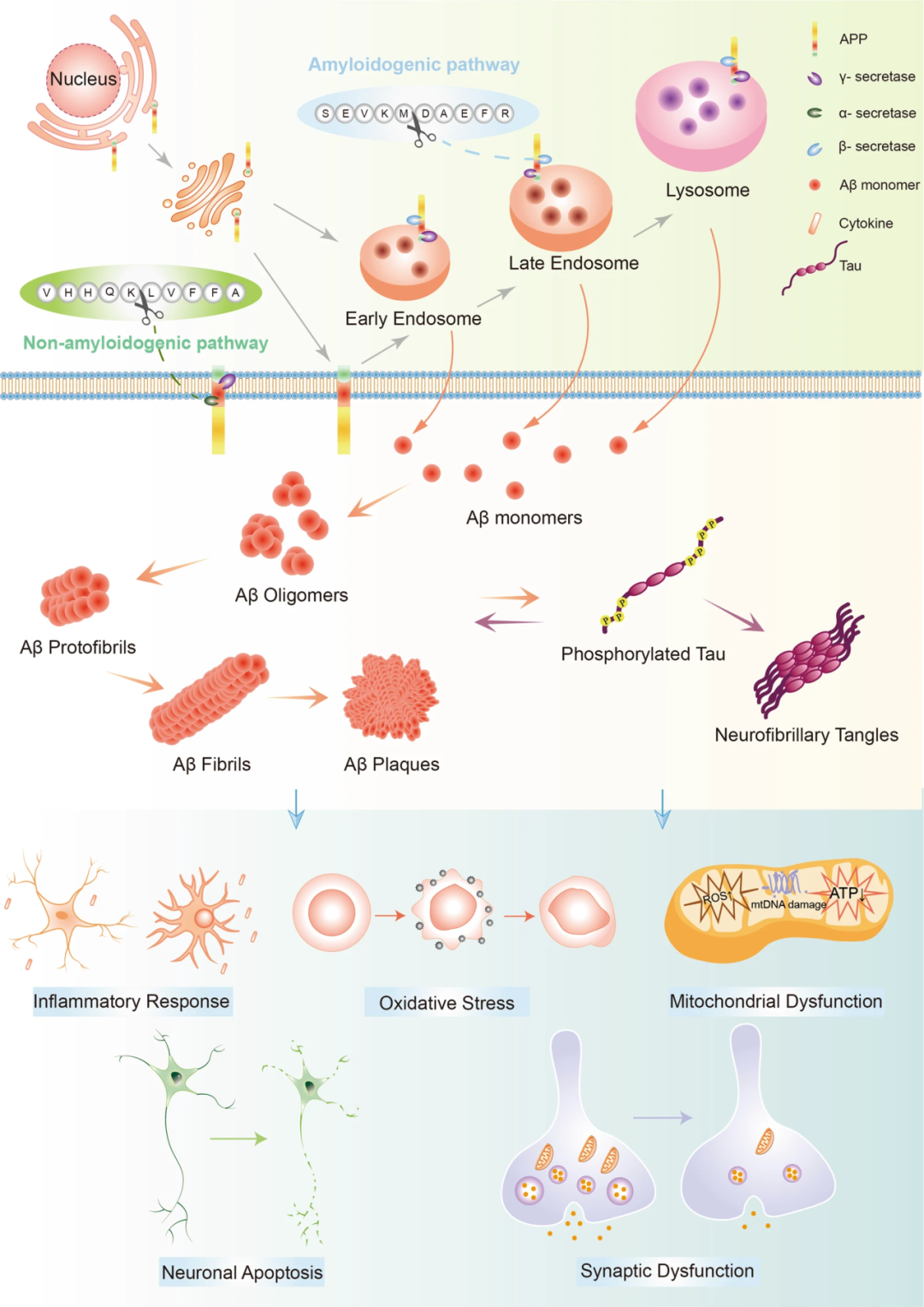
Aβ沉积过程及生理学效应
Aβ寡聚体的负面影响颇多,它能直接与细胞膜的脂质和胆固醇( 胆固醇)成分相互作用,形成通道破坏膜完整性和通透性,导致神经元死亡,同时,富含胆固醇的脂筏为Aβ合成提供了理想环境并促进了Aβ与膜的相互作用。
胆固醇)成分相互作用,形成通道破坏膜完整性和通透性,导致神经元死亡,同时,富含胆固醇的脂筏为Aβ合成提供了理想环境并促进了Aβ与膜的相互作用。
Aβ寡聚体还会改变突触的形态和密度,导致突触可塑性受损,这是AD早期的关键病理表现,也与患者认知下降密切相关。值得注意的是,这一过程中tau蛋白似乎也有角色,多项研究显示,缺失tau蛋白可防止Aβ诱导的神经元功能障碍。
Aβ与tau之间的关系相辅相成,Aβ可通过CDK5、GSK3等加速tau蛋白过度磷酸化,还影响tau的聚集和缠结形成;另一方面,tau蛋白的毒性状态也影响Aβ的产生,敲除APP/PS1小鼠中的tau基因能够抑制APP的淀粉样蛋白生成途径和Aβ产生。
除此之外,Aβ寡聚体在诱发神经炎症、诱导线粒体功能障碍和氧化应激、改变神经化学系统、损害大脑网络等方面都有影响。
以Aβ为靶点的治疗
一直以来,AD都面临着缺少有效治疗的困境。在aducanumab出现之前,AD仅有5种疗法,都只针对AD症状进行缓解,无法真正改变疾病进程。
在AD新药研发赛道中,Aβ是备受关注的靶点。根据ALZFORUM统计( 统计)的数据,截至2023年3月,共有298种新疗法在研,其中76种以Aβ为靶点,按机制可大致分为四类:①减少Aβ形成,②增加Aβ降解和清除,③中和可溶性Aβ寡聚体,④直接抑制Aβ聚集。
统计)的数据,截至2023年3月,共有298种新疗法在研,其中76种以Aβ为靶点,按机制可大致分为四类:①减少Aβ形成,②增加Aβ降解和清除,③中和可溶性Aβ寡聚体,④直接抑制Aβ聚集。
目前,aducanumab和lecanemab拿到FDA( FDA)的通行证,在此之前已有38种药物因无效或毒副作用中止开发。
FDA)的通行证,在此之前已有38种药物因无效或毒副作用中止开发。
BACE1抑制剂和γ分泌酶抑制剂在很早就走进了死胡同。BACE1与许多其他天冬氨酸蛋白酶结构相似,且活性位点的尺寸相对较大,很难被小分子精准( 精准)靶向,所有BACE1抑制剂已经宣布停止研发。类似的,γ分泌酶抑制剂也因为严重的副作用终止了临床研究。
精准)靶向,所有BACE1抑制剂已经宣布停止研发。类似的,γ分泌酶抑制剂也因为严重的副作用终止了临床研究。
比起小分子药物,免疫( 免疫)疗法更被看好。主动免疫例如ALZ-101、ACI-24、ABvac、UB-311等AD疫苗已经进入临床试验阶段,其中UB-311在2022年3月进入了FDA的快速通道。
免疫)疗法更被看好。主动免疫例如ALZ-101、ACI-24、ABvac、UB-311等AD疫苗已经进入临床试验阶段,其中UB-311在2022年3月进入了FDA的快速通道。
前文提及的aducanumab和lecanemab则属于被动免疫,除了这两种之外,还有gantenerumab、crenezumab、donanemab、solanezumab进入临床阶段。但同类药不同命,A和L已获批,D眼看也在获批路上,G/C/S却效果不佳难以继续了。
由此可见,抗Aβ疗法的研发成功率属实不高。阻碍之一就是,虽然Aβ寡聚体有细胞毒性,但是生理水平的可溶Aβ也有它固有的生物学功能,包括增强长时程增强(LTP)、刺激神经元分化、提高大脑修复损伤、抑制氧化应激、抗菌、抗肿瘤等。在治疗时,必须考虑到这些功能——理想状态下,应当更精确地靶向有毒的原纤维和低聚物,保留正常水平的Aβ单体。
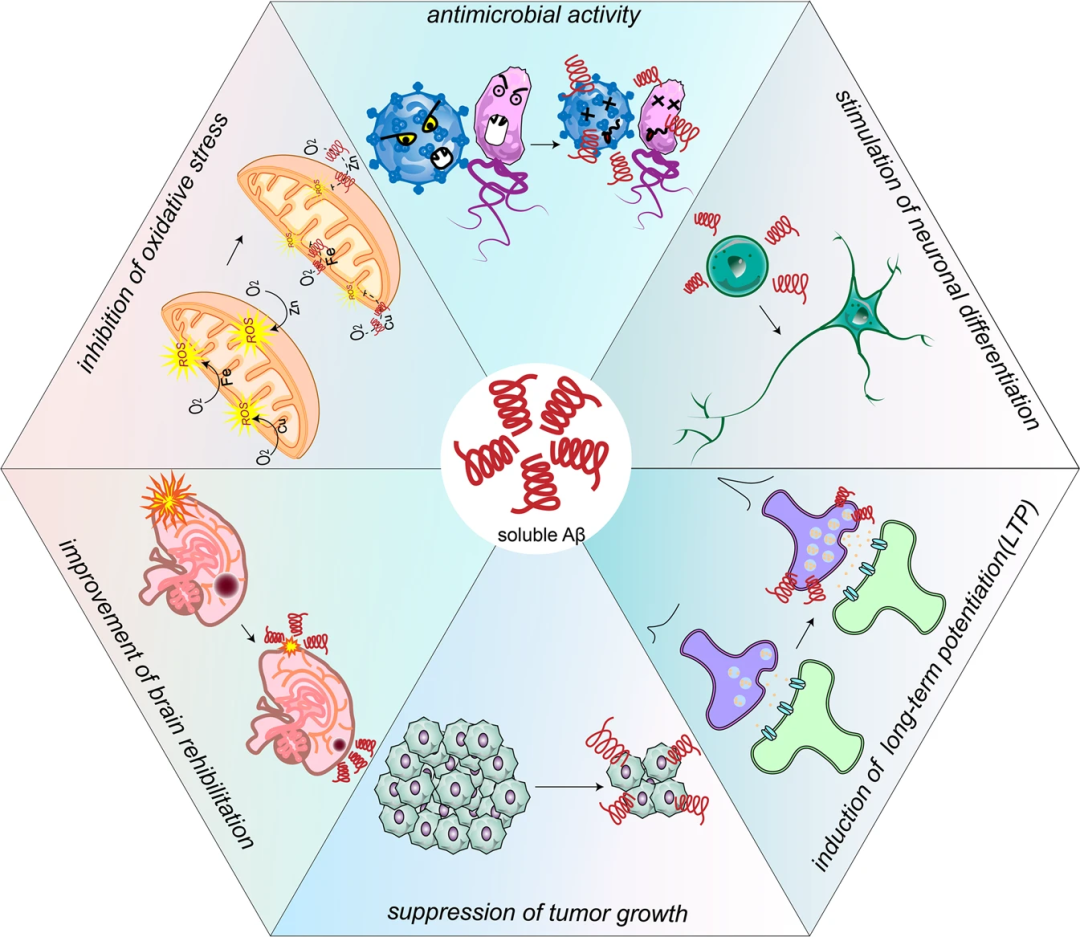
Aβ的生理功能
同时,我们在基础研究和临床研究上也有欠缺。
AD是一种复杂的疾病,受遗传、生活方式和环境因素多方面影响,虽然我们现在已经有了一些转基因动物模型,但它们并不能真正地反应迟发性AD的发展,一个例子就是,小鼠模型尚未复现AD患者中存在的广泛神经元丢失现象。
临床方面,Aβ沉积时间实际上非常早,可能早于症状出现数十年,这就为寻找真正的治疗窗口带来了很大的困难。找到合适的生物标志物来鉴别出AD的早期阶段对于治疗至关重要。
综述中也讨论了未来Aβ疗法前行的方向。
研究者认为,考虑到AD复杂的疾病表现,同时开展针对多种病理的联合疗法,应当能够更好地应对病理级联反应。而基于机制的疗法在无症状阶段启动能够取得更好的效果。
此外,源自人类多能干细胞( 干细胞)血管系统的脑类器官应该可以解决这个问题。
干细胞)血管系统的脑类器官应该可以解决这个问题。
用于早期筛查( 筛查)近期也有新研究发现了有力的新标志物,或许能够改变当前的诊断框架。
筛查)近期也有新研究发现了有力的新标志物,或许能够改变当前的诊断框架。
声明:本文内容由平台创作者发布,内容仅代表作者本人观点;如内容涉及违法、侵权等情形,请及时联系工作人员处理!工作人员微信:pckt6842。



