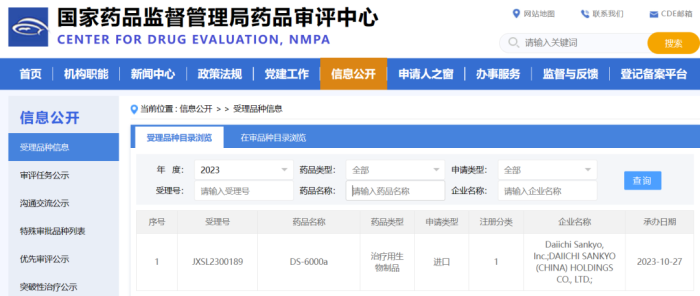
DS-6000a
DS-6000a(Raludotatug deruxtecan,R-DXd)是一款靶向CDH6的ADC药物,由人源化抗CDH6 IgG1单克隆抗体,DXD作为payload,四肽的可裂解连接子组成,DAR值约为8。
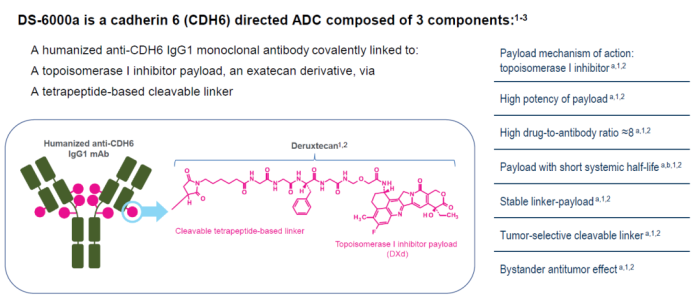
钙粘蛋白6
钙粘蛋白6(Cadherin-6,CDH6)是钙粘蛋白家族蛋白成员,参与细胞间粘附、器官发育和上皮间质转化。CDH6被发现在多种肿瘤组织中过度表达,尤其是在卵巢癌(OVC)和肾细胞癌(RCC)。临床前研究表明, DS-6000a对表达CDH6的肾细胞癌和卵巢癌细胞表现显著的抑瘤作用。
DS-6000a临床研究结果
近期2023ESMO大会上也公布了DS-6000a单药治疗既往经治卵巢癌患者:首次人体I期研究(NCT04707248)的亚组分析。患者为给药剂量分别为4.8mg/kg、5.6mg/kg,6.4mg/kg及8.0mg/kg,每三周给药一次的卵巢癌患者,共入组60例患者,既往治疗线数为4线,68.3%既往使用过贝伐珠单抗,65%既往使用过PARP抑制剂。
临床研究结果表明:


临床效果方面
在可评估的49例患者中,确认客观缓解率(Confirmed ORR)46%,其中1例完全缓解(CR),22例部分缓解(PR),疾病控制率(DOR)98%。
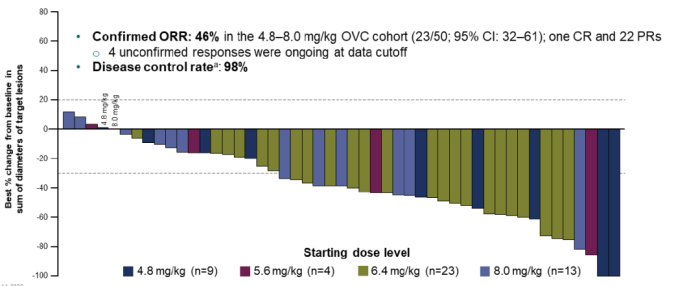
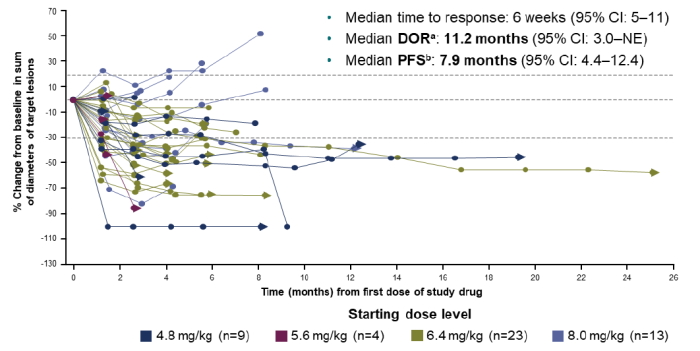
中位响应时间为6周,中位无进展生存期(mPFS)为7.9个月,中位持续缓解时间(mDOR)11.6个月。


安全性方面
从安全性来看:≥3级治疗相关不良反应36.7%:其中贫血11例(18.3%),中性粒细胞计数下降7例(11.7%),血小板计数下降3例(5%)。TEAE导致停药9例(15%),TEAE导致剂量减量15例(25%),TEAE导致治疗中断22例(36.7%)。在8mg/kg剂量组出现2例5级间质性肺炎导致死亡。
撰稿人 | 江篱 药渡Daily
责任编辑 | 胡静
审核人 | 何发
声明:本文内容由平台创作者发布,内容仅代表作者本人观点;如内容涉及违法、侵权等情形,请及时联系工作人员处理!工作人员微信:pckt6842。



