免疫疗法方兴未艾,并在肿瘤治疗中展现出极佳的治疗效果,而抗肿瘤T细胞疗法
细胞毒性CD8 T细胞可以直接杀死肿瘤细胞,是在临床使用的许多免疫治疗方法中动员的关键武器。然而,肿瘤组织能够创造严酷的微环境,招募免疫调节细胞,并诱导抑制T细胞功能的信号分子的产生,从而阻碍了T细胞的功能、聚集和肿瘤浸润
这些研究表明抗肿瘤T细胞疗法的疗效会因为肿瘤组织的抵抗性反应而逐渐衰弱,那么,我们该如何去规避这一现象的发生呢?
2019年12月11日,美国田纳西州孟菲斯圣犹达儿童研究医院迟洪波团队在Nature
论文研究发现,REGNASE-1蛋白的缺失延长了抗肿瘤CD8 T细胞的存活,增强了它们的功能,使T细胞能够更好地、更有效地与癌症作斗争

免疫细胞抗肿瘤疗法深刻地改善了对某些恶性肿瘤的治疗,最常见的便是过继性T细胞治疗(ACT)CAR-T疗法这一疗法在治疗白血病等血液肿瘤上是非常成功的
尽管免疫细胞疗法具有巨大的潜力,但目前ACT的治疗效用是有限的,因为回输到患者体内的改良T细胞往往仅能短暂存在,而且常常无法克服肿瘤组织的抵抗性作用。正常情况下,机体内抵抗了病原体或肿瘤细胞后,会留下一类被称为记忆T细胞长寿命细胞,它们是自我更新的,如果再次遇到相同的感染或恶性肿瘤,它们可以迅速增殖产生大量的细胞毒性CD8 T细胞。然而,如果不能消除感染或肿瘤,细胞毒性T细胞将逐渐失去其功能
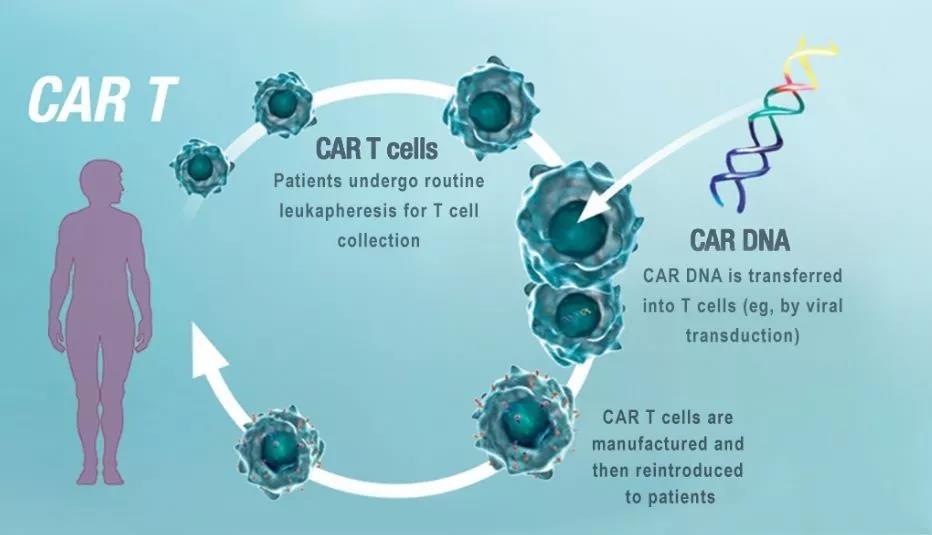
用于ACT的理想T细胞群能够浸润肿瘤并大量积累,同时保留细胞毒性功能和自我更新能力。但T细胞分化为细胞毒性CD8T细胞损害了成功保留了形成长期记忆细胞的潜力。研究者于是提出了这样一个问题:是否有一种策略可以在ACT的T细胞中诱导出这两种有益的性状
研究表明,在复杂的肿瘤微环境中,CD8 T细胞需要有强烈的新陈代谢,以维持生存所需的营养和能量需求,从而保持其抗肿瘤活性。
于是该团队等利用CRISPR/Cas9文库筛选技术3000多个与T细胞代谢相关的基因研究团队鉴定了200多个基因但有4个基因的破坏会导致更多的T细胞浸润肿瘤组织
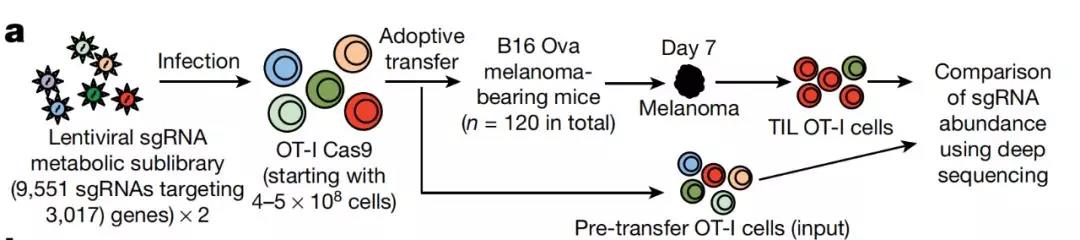
这4个基因中作用最显著的是编码REGNASE-1酶的基因2000倍黑色素瘤急性淋巴细胞白血病
为了更好地理解REGNASE-1缺失导致T细胞在肿瘤组织中持续性增加的原因,作者分析了REGNASE-1缺陷型细胞和野生型细胞的基因表达谱。REGNASE-1的缺失与记忆T细胞分子特征的增加有关,表明存在比正常群体更大的长寿命记忆样细胞,这些细胞可快速增殖产生细胞毒性CD8 T细胞。
Regase-1缺失的CD8T细胞表现为线粒体功能显著增加(线粒体是提供细胞能量的关键来源的细胞器),包括产生能量和消耗氧气的能力。这是十分值得注意的,因为这种能力在抗肿瘤T细胞中经常受到损害

REGNASE-1缺陷的这些联合效应若能应用于ACT的CD8 T细胞和CAR-T细胞,那么便能使ACT免疫疗法产生质的飞跃——重编程T细胞在靶向的癌症中积累并随时间保持活性。
为了进一步了解这一机制,研究团队使用CRISPR/Cas9敲除文库
转录因子BATFPTPN2SOCS1
研究团队报道了REGNASE-1缺失的肿瘤记忆样细胞和细胞毒性CD8 T细胞中,其细胞毒性蛋白的表达均高于野生型CD8 T细胞
如果REGNASE-1缺失的记忆样T细胞拥有杀伤肿瘤细胞的能力,那么它又是如何保持自身活性的呢?更有趣的是,研究者表示,REGNASE-1缺失的CD8 T细胞需要遇到特异性识别的肿瘤抗原才能持续保持活性。这可能解释了为什么抗肿瘤T细胞相比于富含T细胞难以接触到肿瘤抗原的脾脏组织,更显著地在小鼠肿瘤组织中的聚集。
肿瘤微环境中的其他因素是否有助于增强REGNASE-1缺失CD8 T细胞的持久性仍有待研究。为此,对REGNASE-1、PTPN2、SOCS1和BATF组合性缺失的CD8 T细胞的代谢特征进行评估可能具有极好的参考价值
这将有助于我们了解这些蛋白对CD8T细胞代谢重编程的影响,以及这对细胞分化和抗肿瘤功能的重要性。此外,在这种情况下找到相关的代谢物可能会为这些CD8 T细胞如何受到营养缺失的肿瘤微环境的影响提供线索。
这项研究为ACT免疫疗法的发展提供了重要的理论依据。十分值得去尝试在CAR-T细胞的制造过程中,利用CD8 T细胞来删除或表达低水平的REGNASE-1基因,并观察其可行性。
最后,鉴于肿瘤细胞中PTPN2是否可以在ACT免疫疗法中以REGNASE-1 CD8 T细胞和PTPN2抑制剂进行联合治疗,从而使肿瘤免疫治疗的疗效更强大、更持久

