艾滋病
更重要的是,HIV作为一种RNA病毒,其基因组具有较高的突变率艾滋病的预防疫苗和治疗药物的开发变得十分困难迄今为止规模最大、最有希望的 HIV 疫苗项目宣布「彻底失败」
那么,科学界是否能找寻到HIV的保守位点
近日,美国霍华德·休斯医学研究所、密歇根大学医学院和罗格斯大学的研究人员在国际顶尖学术杂志Science
此项研究发现HIV基因组中的一个核苷酸可以控制受感染细胞以两种不同的方式读取病毒的遗传密码从而产生两种不同形式但均为HIV复制所必须的病毒RNA
更关键的是,这一核苷酸恰好位于HIV基因组的一个低突变率区域它有望为解决艾滋病耐药性问题的新靶标!

自1981年6月5日,美国艾滋病3600万1200万世界卫生组织中国实际艾滋病感染者约为125万
HIV病毒的高突变率高耐药性何大一鸡尾酒疗法
虽然“鸡尾酒疗法”是一种行之有效的治疗方法,但同时也使得艾滋病的治疗变得十分复杂且药物副作用更大,更重要的是,“鸡尾酒疗法”并非是万无一失和长期有效。因此,开发一种抗艾滋病耐药的新疗法是十分必要的。
早有研究发现HIV病毒的RNA存在两种不同的结构形式
在此项研究中,研究人员发现了一种基于结构的机制可以通过异质转录起始位点的使用来实现HIV-1转录功能的多样化
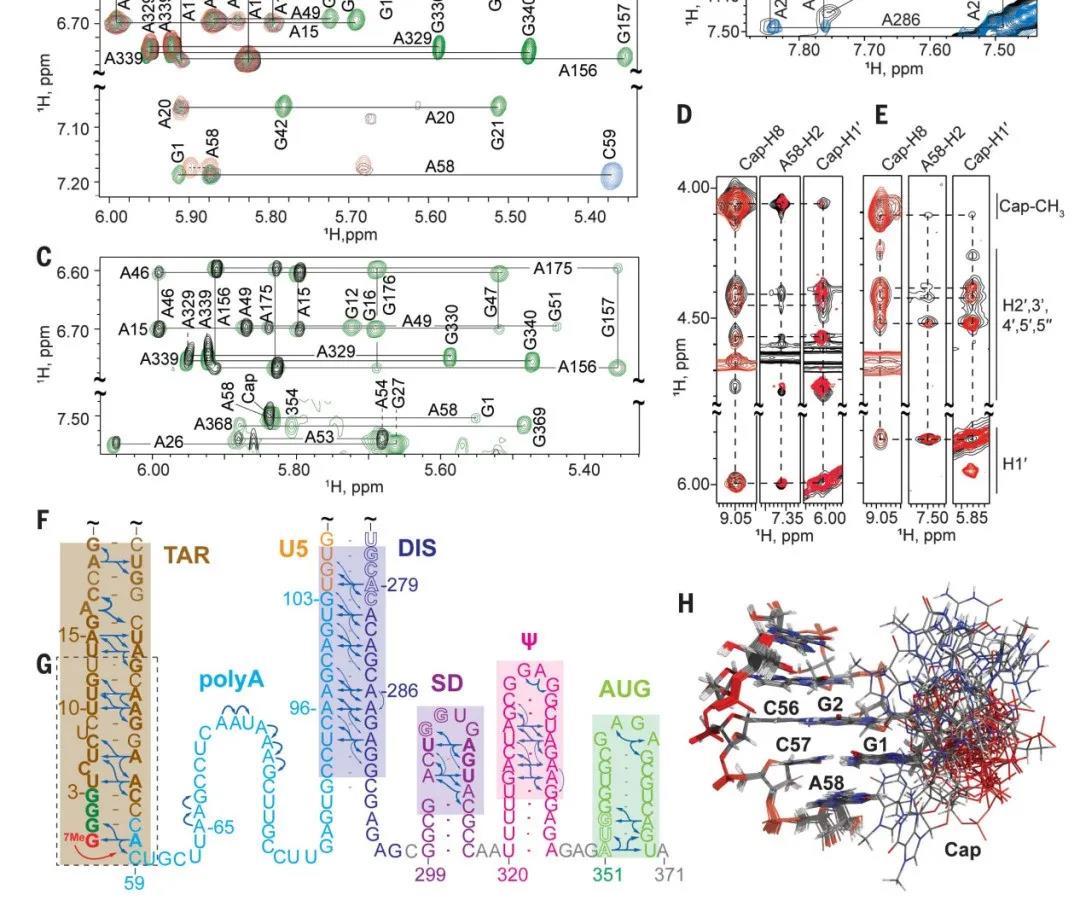
为了了解5'-G的数目如何影响RNA的命运,研究人员使用核磁共振氢谱的方法探测了HIV-1的具有5'-G帽的前体RNA的结构。他们发现与核糖体结合外源性小配体进行结构重塑和功能激活的过程类似,HIV-1转录本的结构和功能由一个或多个5'-G的数目来控制。
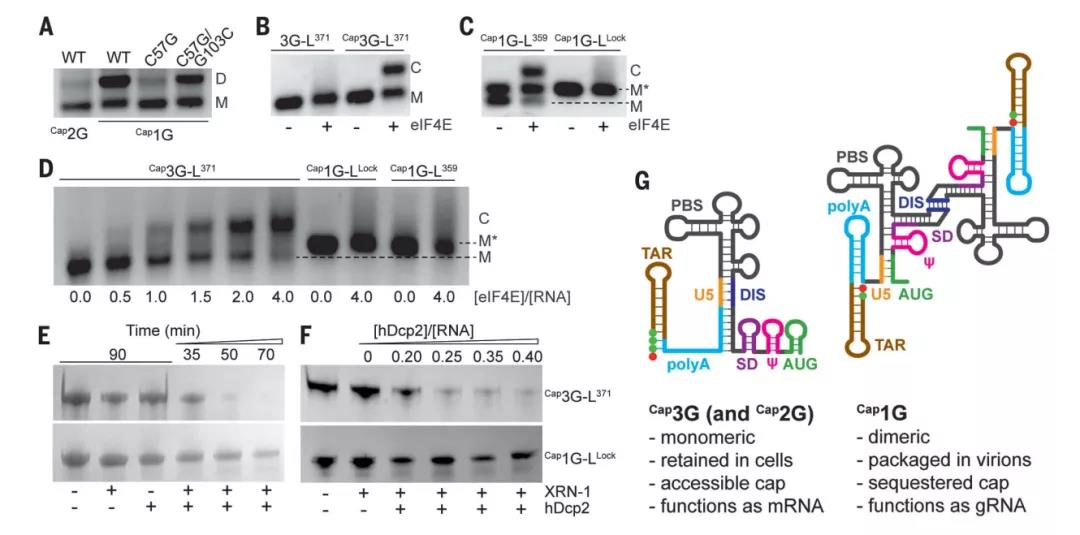
Cap1G转录本具有二聚体的多发夹结构,暴露Gag(HIV的一种结构蛋白)结合位点,同时阻隔了5'-G帽,从而抑制该转录和真核翻译起始因子4E(eIF4E)的相互作用,进而抑制后续的剪接和翻译过程
Cap2G和Cap3G转录本则采用了另一种结构,该结构具有细长的中心螺旋,暴露出剪接供体残基和可接近的5'-G帽以及TAR发夹下游的非结构化残基。暴露的5'-G帽可以与eIF4E结合,而TAR发夹下游的非结构化poly A残基可以促进eIF4E依赖的附加因子的关联,这些附加因子是剪接和翻译所需要的。
该位点处于HIV基因组的高度保守区域,因此,或可成为解决艾滋病耐药性问题的新靶标!
这项研究的影响也可能超出了艾滋病毒本身,甚至于对整个生物学领域都产生深远的连锁效应Issac Chaudry单个核苷酸的差异改变了RNA的结构和功能,这一观点可能会为生物学研究开辟一个全新的领域。
论文链接:

