
对于OOS/OOT调查,FDA等有指导原则,各企业参考其制定内部规程以指导调查。FDA要求调查时要进行书面记录,通常企业会以“调查报告”形式记录调查过程、根本原因、CAPA。但很多人提及调查与调查报告,思路顿断,抓耳挠腮。该文为大家进行调查和撰写调查报告提供些许思路,如有疑义,敬请指正。
通常调查报告至少包括以下内容(包括并不限于):
调查报告命名
事件描述
调查过程
找出的根本原因或可能的原因
风险评估
纠正预防措施
1调查报告命名
通常“调查报告”命名要把事件进行概括,便于存档和随时调阅,查阅的人能够立即知道事件的概要。要包括发生OOS产品的名称、批号、涉及到的检验项目,如为稳定性,还要包括考察条件和检测时间点。
举例:
苯磺酸氨氯地平片(品名)123456批(批号)加速6个月(考察条件和时间)有关物质(涉及到的检验项目)调查报告。
2事件描述
(无论是上报还是书写调查报告均要描述清楚)
描述清楚什么时候、什么人、在干什么、发现了什么(具体到序列名称、序列中包含了什么等),结果是什么?判定标准等。如需要写发生地点:要有识别性和唯一性,增加房间编号,如F13溶出室。
举例:
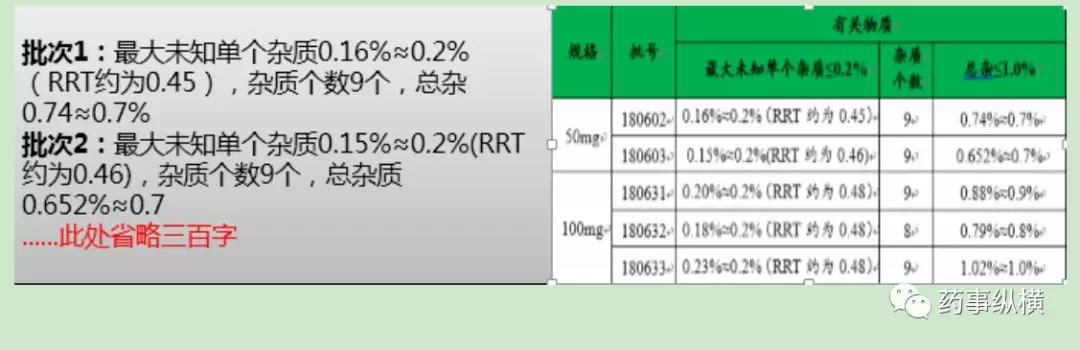
2019年01月15日(时间),质量控制部(地点)王小丫(人物)在计算XXXX片(产品)有关物质(检验项目)时发现:RRT约为0.25单个杂质为0.25%(检验结果要数字化)不符合标准规定,标准规定为≤0.20%(必须写清楚标准规定)。如果数据较多,请用“表格”来表达,清晰、美观、容易分辨。
“大段文字”描述与“表格统计”效果对比
3调查过程
(原则:在结果未判定合格前,一定要保留所有原溶液)
1.通常逆向进行,
2.检验人员一定要仔细回顾检验过程中的现象
3.核对所有的操作与SOP的一致性,
4.对同期检测数据进行汇总分析,
5.如果是稳定性考察过程中出现OOS/OOT,
6.如果为商业批产品出现OOS/OOT,
7.如果溶液不稳定的产品出现OOS/OOT,
8.调查中一定要用到5W工具(5个why)
1W:有关物质中未知杂质为什么会高?可能是供试品被污染
2W:为什么考虑供试品被污染,而不是供试品质量发生了变化?因未知杂质增高,但是已知杂质与历史检验数据无明显变化,含量也无明显变化,同期的加速3个月中未知杂质未增大,所以初步排除供试品质量变化,考虑是否为污染导致。
3W:供试品什么时候被污染?通过回顾实验过程,从接近结果的步骤开始排查,灌注液相小瓶、过滤、稀释、移液、稀释剂、称量过程、研磨过程等……
9. 必要的假设试验:
10. 可能的复测:
11.调查报告中需要增加数据的,采用表格形式统计,
表1123456长期(25±2℃,60±5%RH)
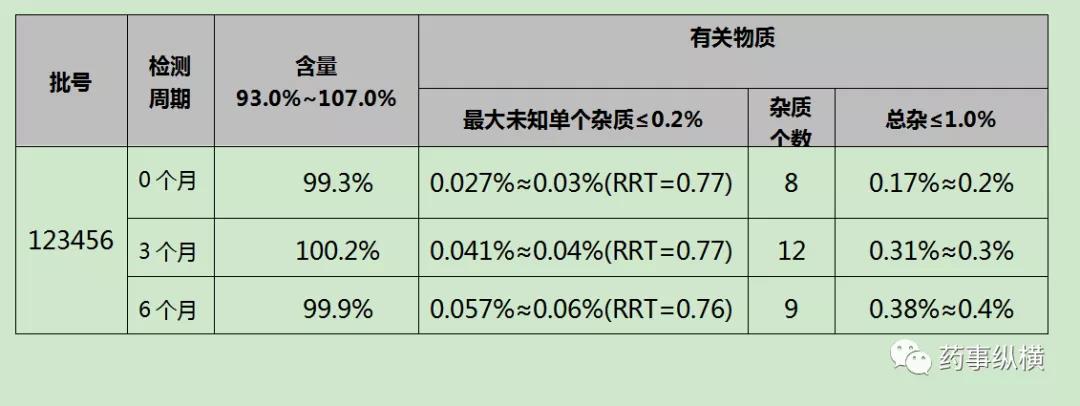
数据汇总完成后,要对数据进行分析。
如,
4原因
(根本原因或可能的原因)
调查出的原因与结论,一定要和发生的异常现象之间有明确对应联系。
以下为OOS/OOT常见原因汇总。
1、含量测定出现OOS/OOT常见的实验室原因:

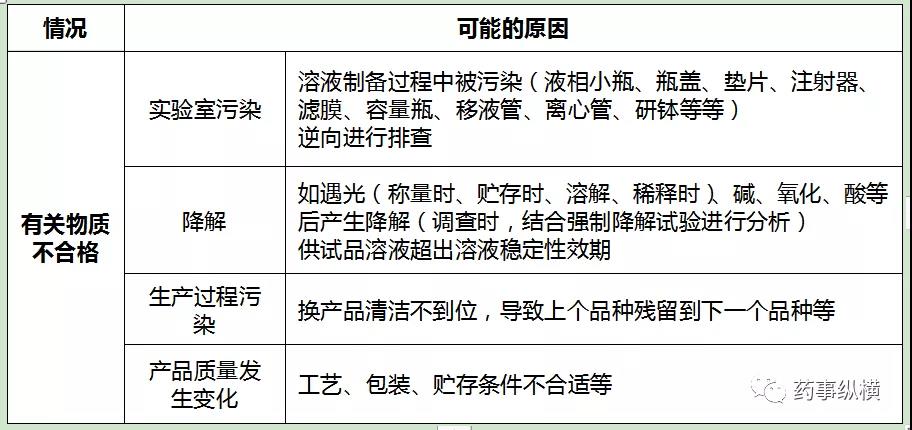
2、有关物质测定出现OOS/OOT常见原因:
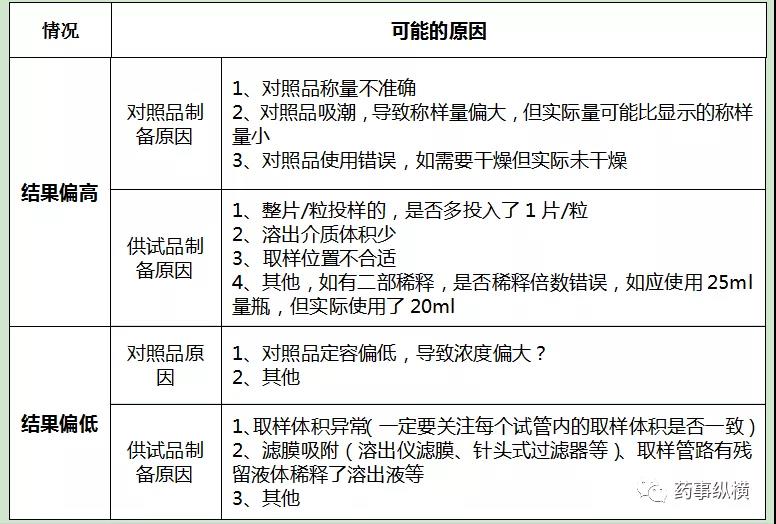
3、溶出度出现OOS/OOT常见原因:
5风险评估
调查出原因后,需要同时考虑其他可能受影响的批次和产品,对这些批次和产品质量进行评估。
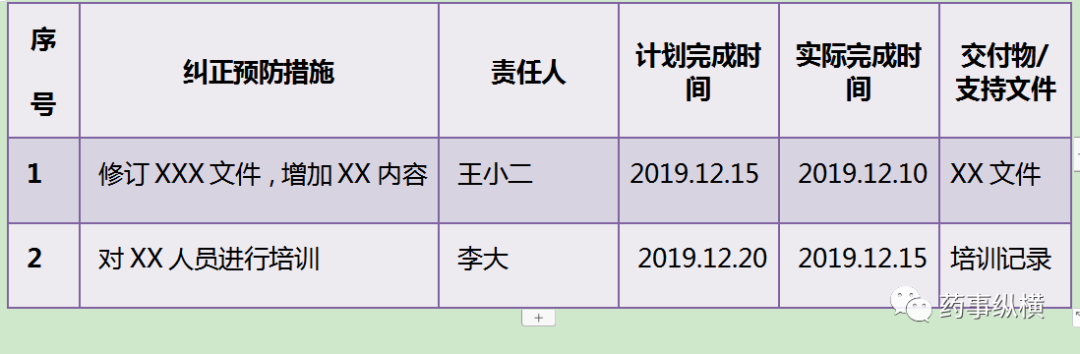
6纠正预防措施
制定纠正预防措施时需要注意:
1、有针对性:
2、有持久性:
2.1能加入SOP的一定加入SOP,不能靠人传人或者口头培训。2.2操作性的SOP,一定要细化。防止不同人员理解不透彻,或导致误操作。
例如:
中药产品:可以增加提取溶剂加进去、提取完成等之后的颜色描述,萃取的时候是否容易发生乳化,如何预防乳化?乳化之后的有效处理办法等等
化药产品:使用的滤膜材质、厂家,弃去初滤液的体积、溶液制备至检验完成的时间、其他特殊条件等等。
3、一定要分享(培训等):
3.1纠正预防措施一定要大声的、正确的告诉你的小伙伴(本组、本实验室、本公司),才能避免自己和他人犯同样的错误。
3.2培训不能仅针对发生错误人员,应该是全部人员,这样才能有效预防类似事情重复发生。
3.3纠正预防措施一定要认真制定,关系到你和你的小伙伴是否能减少无效的重复工作。
4、要有时限性:
参考文献:
FDA: Investigating Out-of-Specification (OOS) Test Results for Pharmaceutical Production

