文章来源:申秀蕊药闻天下
4月27日,浙江省药品MAH转化平台进行了一期eCTD培训,和泽医药注册部经理申秀蕊做了报告《eCTD申报应用及关键控制点》,干货满满,今天药闻天下将报告主要内容分享给大家。
01什么是eCTD?
eCTD,electronic common technical document,电子通用技术文档,由ICH组织制定发布的规范,药品注册申报时申报企业按照规范编制结构化的药品电子申报资料,监管机构以电子化形式受理和审评,实现申报资料由递交到审评的规范化、标准化、信息化和电子化。
eCTD 是以XML为基础,规范和展示CTD文件的名称和架构。
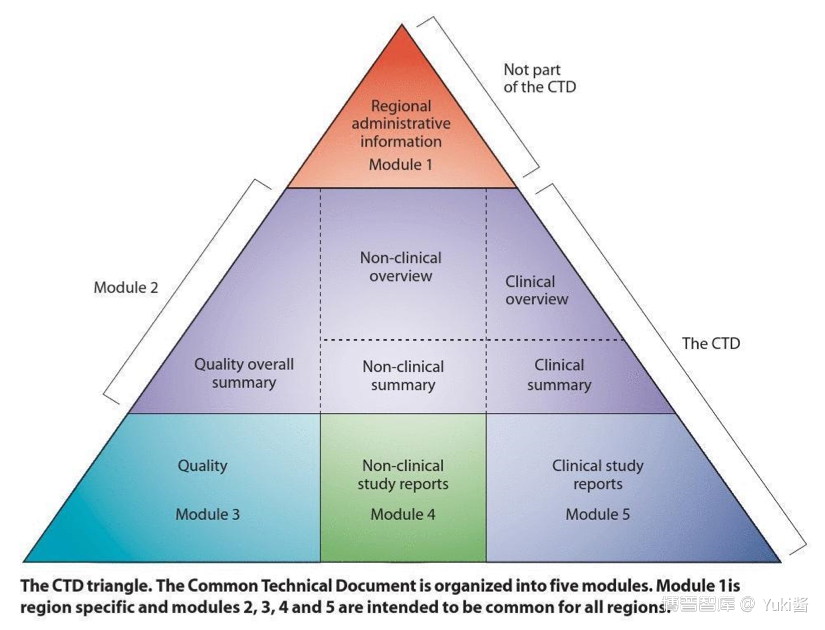
其中,模块1为区域性要求,本模块的内容和格式由相应的监管机构规定。模块2、3、4和5为通用要求,遵守这4个模块的格式,能为各监管机构所接受。
eCTD是在CTD的基础上加入了可扩展标记语言(XML)技术,将符合通用技术文档(CTD)规范的药品申报资料以电子化形式进行组织、传输和呈现,实现药品全生命周期的管理。
02eCTD的规划与发展?
从 2008 年起,FDA 开始鼓励以 eCTD 格式提交相关新药申请材料。美国从 2010 年开始将新药上市注册申请、生物制品许可申请和仿制药注册申请纳入 eCTD 观念里范围。2015 年 FDA 正式宣布,到 2017 年中旬前大部分药物的申请将被要求采用 eCTD 提交,在这一期限之后,FDA 将不再受理要求范围之内文件的纸质申请。
全球已经有超过 40 个国家和地区已经采用了 eCTD 格式递交注册文件,现在执行的标准是 2008 年发布的 V3.2.2。
中国国家药品监督管理局(NMPA)于 2017 年 6 月加入 ICH, 2018 年 7 月完成 eCTD 后台管理系统(验证,审阅,文档管理)招标,并于 2019 年相继发布了技术规范、验证标准和申报指南等规范。

03eCTD带来的价值
(1)有利于全球研发申报
促进药品国内外同步申报,便于申报资料的重复利用,加快药品全球同步上市
(2)提高药品申报成功率
依据eCTD技术规范和申报指南,通过eCTD申报软件,加快申报资料准备,有助自查和修改,及时更新法规变化,提高申报成功率。
(3)加速审评,缩短上市时间
电子化审评方式,大幅度提高审评效率,缩短审评周期,缩短药品上市时间。
(4)申报全生命周期管理
通过对申报资料全生命周期管理,实现对提交文档的历史追踪和版本管理,避免错报重报,便于现场检查和核查
04eCTD 长什么样?
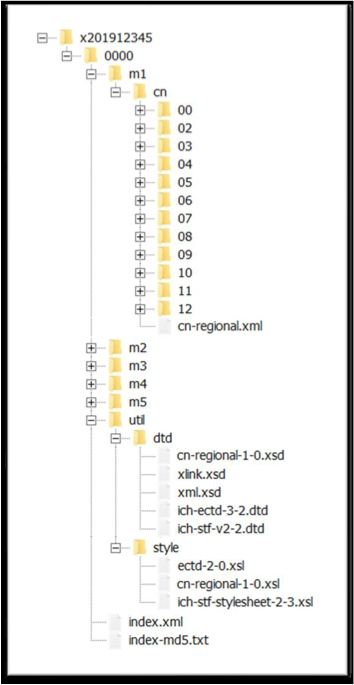
(1)eCTD结构:
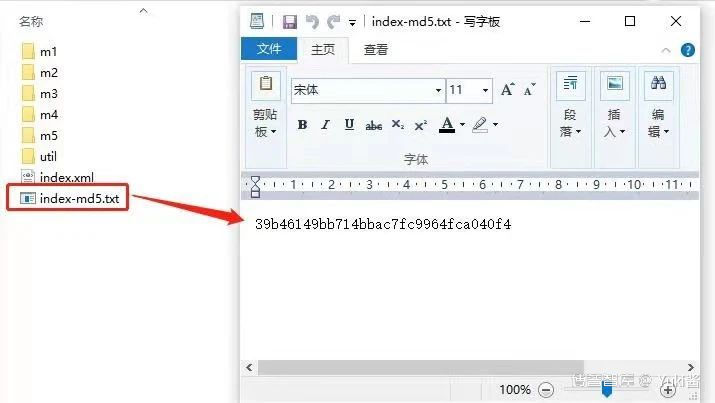
eCTD新药申请首次提交的全套申报资料输出文件夹的结构示例,包括模块一至模块五的内容文件,2个骨架文件(XML文件),1个存放DTD相关文件的util文件及1个存放MD5值的文本文件。
如下图所示:
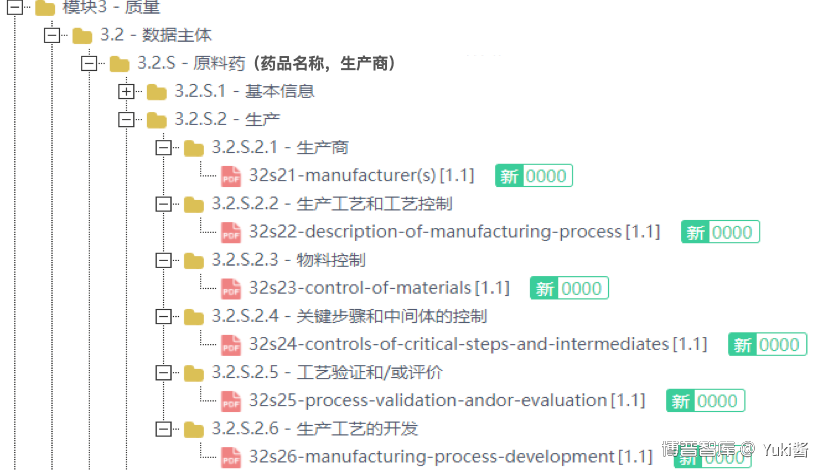
(2)eCTD申报资料结构:
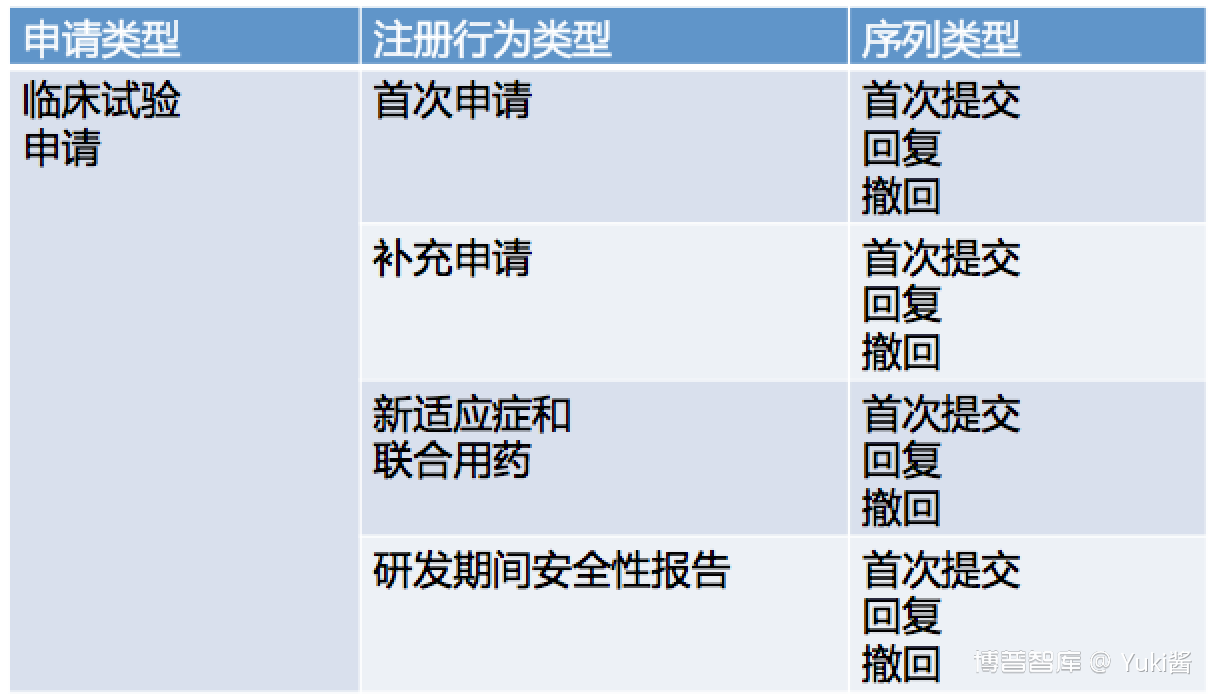
eCTD申报资料由申请、注册行为和序列三个层级来定义。

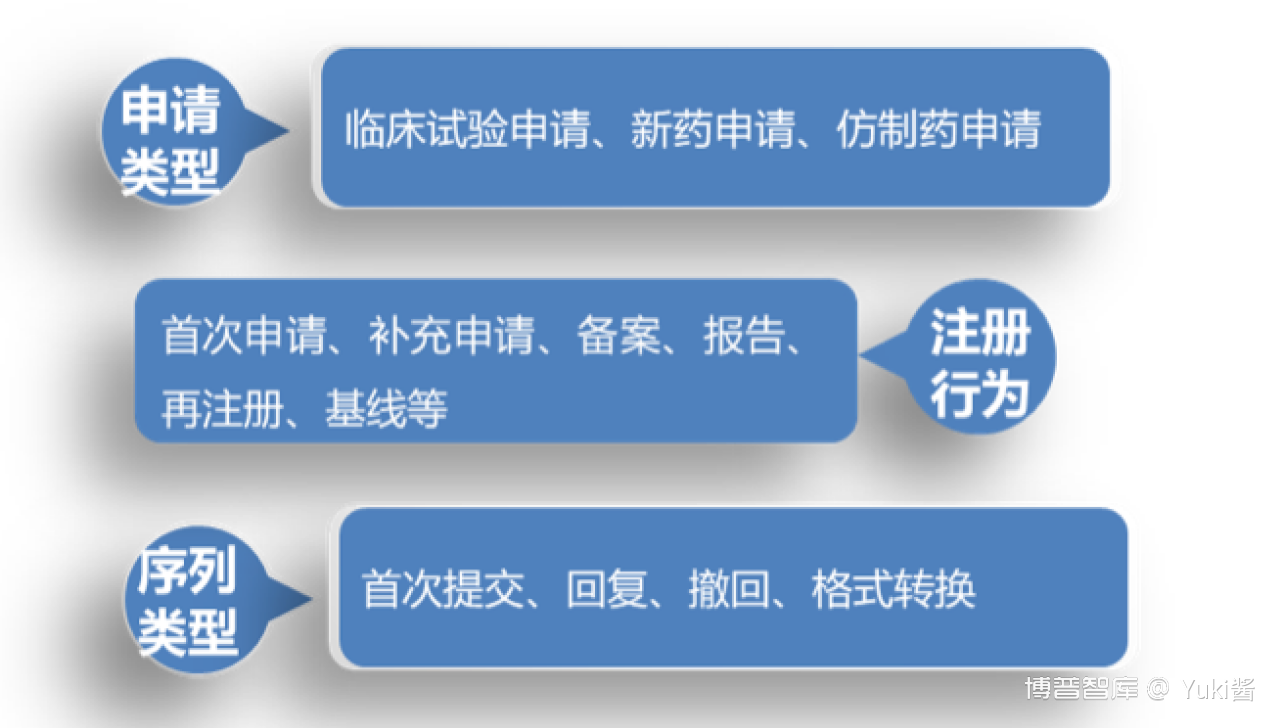
申请、注册行为和序列的关系:
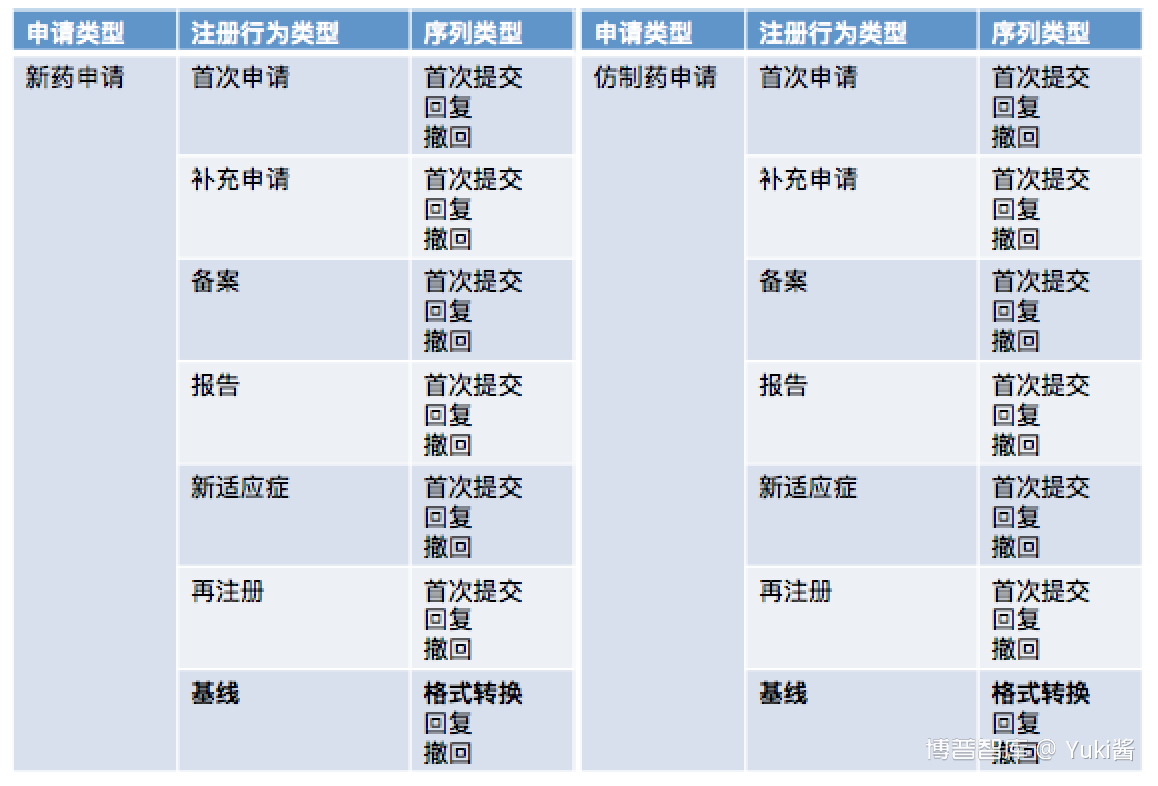
基线指申请人将已以纸质递交获批上市许可的药品从纸质递交格式转换为eCTD提交的注册行为。仅为格式转换,不涉及变更。
05中国 eCTD 申报要点
1. Once eCTD, always eCTD;
2. 序列号应从0000开始,每次提交时须加1,并按先后次序提交,不得跳号提交;
3. 文件夹不允许存在空文件夹;不允许存在占位文档;
4. 不得对提交的申报资料中的文件进行任何压缩、加密处理;
5. 文件及文件夹命名允许使用字符要求、路径要求;
6. PDF标准:超过5页,需提供目录(TOC/LOT/LOF/LOA)和书签;
字体字号、字体颜色;
7. PDF文件内容可复制、可检索要求;OCR
8. 建立书签和适当的超文本链接;
9. 应对提交的eCTD申报资料进行电子签章1.0说明函;1.2申请表;1.13申报资料真实性说明;
10. 3.2.R章节增加扩展节点:区域性药学信息模块4中4.2.X章节和模块5中5.3.1.x-5.3.5.x章节的文件应使用STF;
11. 建议提交基线;基线类型的注册行为对书签和超文本链接不做要求;
12. 外文资料要求:引入了“xml:lang”属性—语言属性设置为中文,对应的文件被识别为中文申报资料;外文参考资料将不受某些eCTD验证标准的约束;
13. 技术验证:错误:拒收;警告:说明函中解释;
验证出版后,不能更改文件,否则Checksum会更改,被拒收;
14. 提交:CD-R/DVD+R/DVD-R,不得使用双面DVD;光盘封面;档案袋封面。
06eCTD简明流程
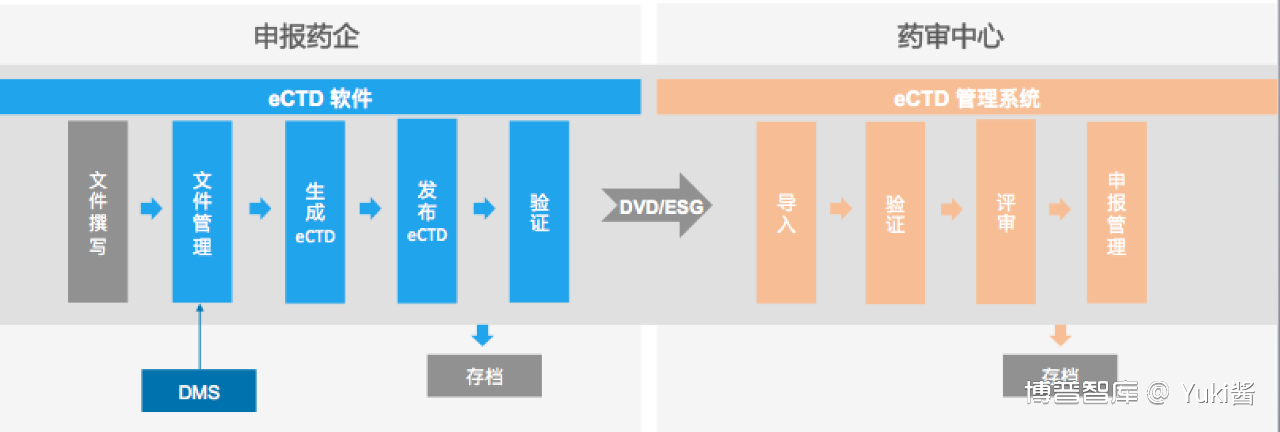
1. 申报企业通过文档编辑工具如微软的Word进行文件撰写后,通过eCTD软件管理申报文件,进行eCTD文件的生成、验证和发布,将发布的文件刻录成DVD的形式提交至监管机构。
2. 监管机构将电子文件导入监管端的eCTD系统进行验证、评审和申报管理。
3. 强烈建议采用DMS,构建完整的ECTD系统,本质上完成文件,注册的全生命周期管理。DMS可以自备(最好能够兼容到拟采用的eCTD系统)。部分eCTD系统自带(free or charge)
07
什么时候申报资料会被拒收?
(1)未按照申报指南要求制作和提交eCTD申报资料将会导致申报资料的拒收或对后续的审评审批工作造成影响。
(2)监管机构接收到申报资料后将进行病毒检查,如发现病毒将导致申报资料的拒收;
(3)对于首次申请后进行的补充申请、再注册等其他后续注册行为的撤回,需要提交撤回序列,否则会导致后续提交申报资料的拒收;
(4)任何“错误”均会导致申报资料的拒收
(5)未按要求进行电子签章的eCTD申报资料将会被拒收
08eCTD验证常见问题

09eCTD制作常见问题

1. word常见问题
如:
(1)字体、字号、颜色或方框
(2)纸张要求、页面方向
(3)粒度文件:放错位置或不按照粒度要求撰写
(4)文件名称错误
解决方案总结:
(1)统一办公系统、统一版本;统一撰写标准
(2)撰写时就按照颗粒度要求撰写文件;
(3)制定格式模板
(4)设定QC环节
(5)加强内部培训
(6)RO早期介入
2. PDF常见问题
(1)目录超链接与书签不一致或目录中无链接
(2)书签与文件内容不匹配
(3)超链接指向错误或失效;
(4)未提供或不充分的超链接(基线除外)
(5)外文参考资料隐含超链接
(6)书签命名要友好
(7)文档清晰、可复制、可检索

解决方案:
(1)保证最新版本、替换文档及时处理链接问题
(2)PDF验证
(3)eCTD验证器验证
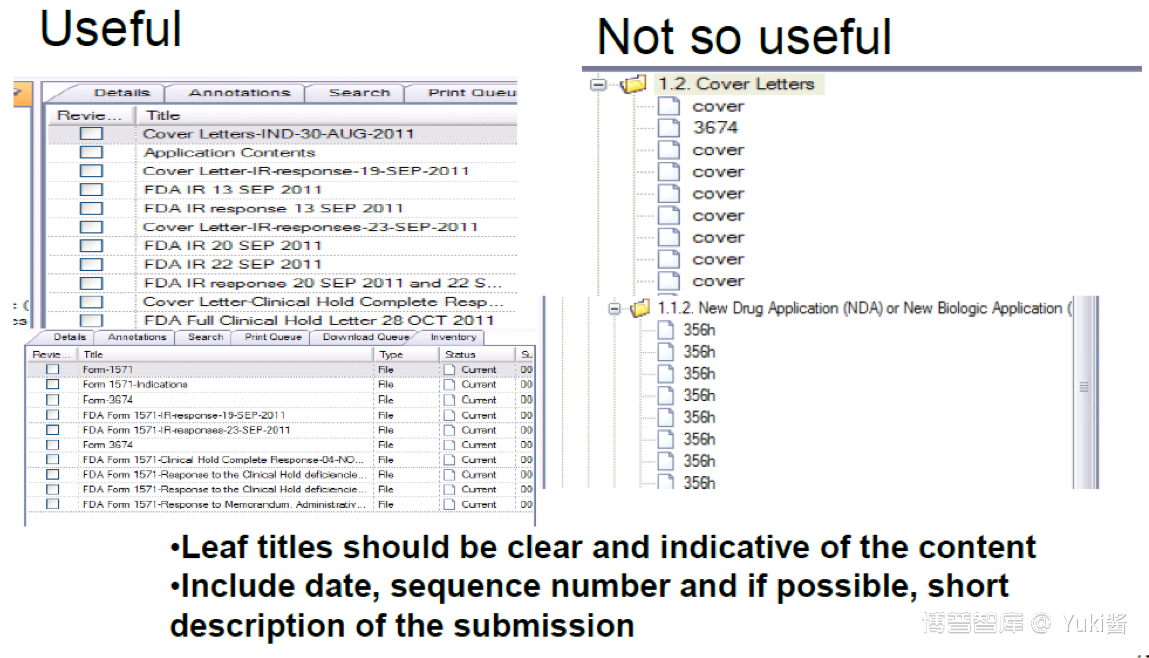
3.leaf titles
4.Checksum常见问题

解决方案:
(1)提供最终定稿,不要反复修改
(2)提高审核签批人员等级
(3)给RO人员流出充分的时间
09如何高效完成一套eCTD?
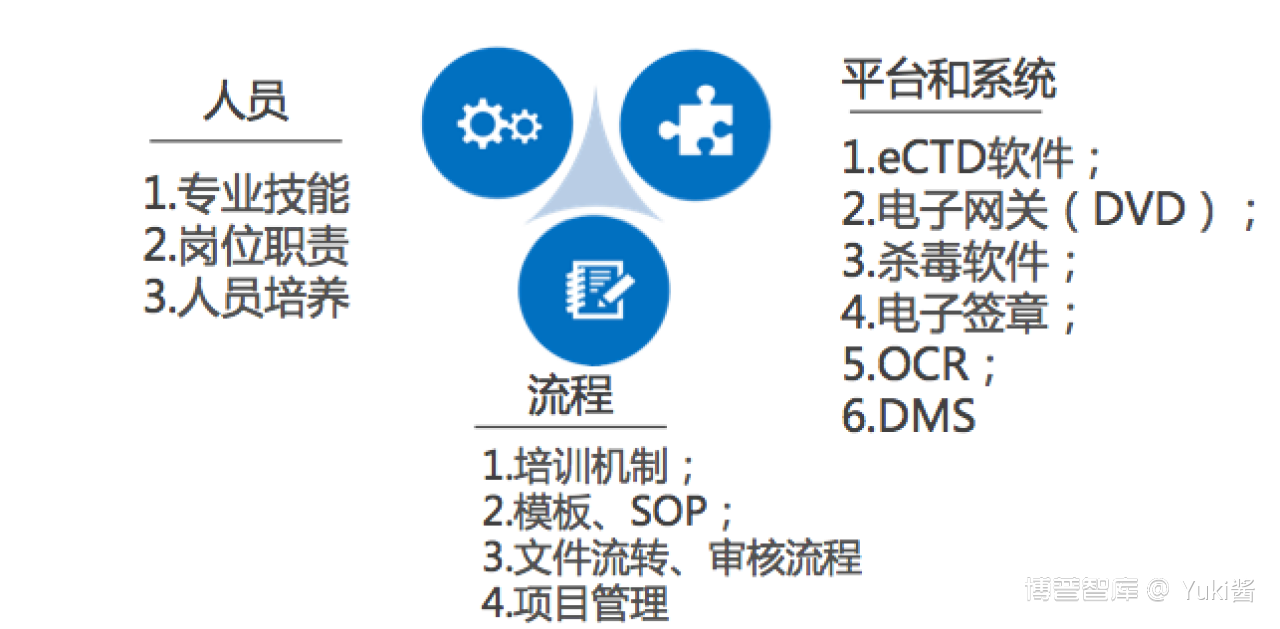
人员:
1. 专业技能:文档编辑技能+相关软件操作技能+法规要求;
2. 岗位职责:谁负责:收集、整理、撰写、定稿;谁负责:eCTD资料审核、编辑、验证、发布、归档;谁负责:项目管理、风险管理;谁负责:软件维护
3. 人员培养:法规更新、法规培训、验证发布问题汇总及经验分享、相关SOP制定和模板编制;
流程:
1. 培训机制:培训频率;
2. 模板、SOP:申报资料撰写格式模板、申报资料审核清单、文件命名SOP、文件粒度SOP、文件上传SOP、图谱交叉索引SOP;文档内链SOP等;(规避人员流失风险)
3. 文件流转、审核流程:资料流转程序、资料审核程序(确保少返工);
4. 项目管理:申报计划安排及节点监控(不能一味压缩RO时间)
平台和系统:
1. eCTD 软件:软件实力及插件工具;
2. 电子网关(DVD)、杀毒软件、电子签章:早准备;
3. OCR:含OCR功能的扫描仪或专业 OCR 工具;
4. DMS:支持多人在线同步修改同一文档

