本系列谢绝外网站转载,若有所需请联系圈主。
前记:
最近某大企业的注射用奥扎格雷钠可见异物的瓜不小。不懂故事背后的故事,那就学习吧。
顺道整理了一下自己的课件。毕竟埋雷、排雷都是工作呀。
去年受约翻译了USP 1790 注射剂目视检查。
USP 1790 注射剂目视检查(可见异物)-2
USP 1790 注射剂目视检查(可见异物)-3
USP1790 注射剂目视检查(可见异物)-完
今年找全USP44,顺道看了一下,关于这个主题没有修订,恰好原版两个图找了,温故而知新罢了。
感觉内容很好,分享一下。
一共19页,分三五更放出吧,我需要再校对一次。
1. 范围
1.1介绍
本章提供了对注射剂可见颗粒的检查指导。在本章中,“颗粒(particle)”、“微粒(particulates)”和“悬浮微粒(particulate matter)”是等价的,意思相同。在< 788 >注射剂中的“悬浮微粒”中,悬浮微粒被定义为“流动的未溶解的颗粒,而不是气泡,在溶液中非预期出现” 。目视检查是一个概率过程,观察到的对给定产品中可见颗粒的具体检测概率会随着产品配方、颗粒特性和包装设计的不同而变化。本章讨论的方法也适用于其他可见缺陷的检测,而不仅仅是注射剂中的可见颗粒< 790 >;但对合格的判定而言,全面检查过程至关重要。这些缺陷包括但不限于容器完整性缺陷,如裂纹、塞子错位或密封不完整,任何这些缺陷都可能危及产品的无菌性。额外的容器缺陷【1】以及其他产品特性,如填充水平、变色或澄清度,也可以在目视检查中检测到,不合格品应使用本章所述的方法予以拒绝。对这些其他质量属性的检查通常与对粒子的检查同时进行。本章的主要重点是供人工检查使用的方法;然而,半自动化和自动化的方法也被药典讨论和允许。
1.2相关章节
注射和植入药物产品< 1 >提供了注射剂型和与之相关的质量测试的概述。另外一章< 790 >已被添加到USP-NF中,为注射产品的常规检验程序提供了明确的定义;其目标是符合产品基本不含可见颗粒物的预期。此外,在治疗性蛋白注射剂中的亚可见颗粒物<787 >、< 788 >和眼科溶液中的颗粒物< 789 >中提供了检测亚可见颗粒物的信息。治疗性蛋白注射剂中亚可见颗粒物的测量< 1787 >和注射剂和眼科溶液中颗粒物的测定方法< 1788>提供了关于亚可见颗粒物的测量方法的额外支持信息。
1.3缺陷预防
虽然本章聚焦在检测和去除发现的可见颗粒的产品单元,但防止这种污染的需求不应该被忽视。任何人工或自动化的检测过程都不能保证所有可见颗粒物或其他可见缺陷的完全清除;因此,预防这些缺陷是一个重要的考量。良好的工艺和产品设计,以及环境控制,是确保产品处于较低颗粒负荷的可靠要素。为确保缺陷在整个加工过程中得到控制,制造商应考虑基于生命周期的检查方法【2】。该方法首先基于传入的组件标准开发质量属性,然后是组件级验收测试。它延伸到组件准备和产品填充程序,然后是填充产品的100%的过程中检验,最后是成品的最终验收抽样和测试。生命周期方法必须延伸到购买的即用型部件,如容器或瓶盖;因为在接收后和灌装到二次包装(如托盘、桶、盖和袋)之前,没有机会清除颗粒物。稳定性和留样检查,客户投诉评估和内部调查程序支持这一综合方法。检查生命周期由以下部分组成和支持:子周期涉及确认、维护、人员培训、用法医分析方法对内容物颗粒进行分类,以便随后进行缺陷表征(和可能的识别)、以及在每个关键区域内使用标准和缺陷样本。生命周期的最后一个要素是来自每个工序领域的趋势和数据审查的反馈循环,从而产生支持持续过程改进的机制。
2. 背景
2.1检验过程的能力
对注射药物进行目视检查是必要的,以尽量减少注射药物给患者带来的意外颗粒。这种检查还提供了拒绝完整性受损的容器的机会,例如那些有裂缝或密封不完整的容器,这些会对产品的无菌性造成风险。尽管这些缺陷发生的频率很低,而且发生的随机性很大,但检测这些缺陷的愿望导致了长期以来对每个成品单元都要进行检查(100%检查)的期望。尽管零缺陷是我们的目标,并且应该推动过程的持续改进,但是对于可见颗粒来说,考虑到当前的包装部件、加工能力和检验过程的概率性质,零缺陷并不是一个可行的标准。
检测过程是概率性的:检测的可能性是可见属性的累积函数,如粒子数量、大小、形状、颜色、密度和反射率。因此,理解人的表现是建立视觉检查标准的关键。眼睛中个别感受器的理论分辨率为11μm,但据报道典型的分辨率为85-100μm【3】。几项研究汇总的检验结果分析指出【4-6】:使用单球形颗粒制备的标准样进行的实验表明,在2000 - 3000勒克斯漫射照明下,对10毫升透明小瓶的透明溶液中含有单一50 μm颗粒的选定样品的检出概率(PoD)仅略大于0%。对于颗粒大小为100μm的标准样本,检出概率增加到大约40%,对于单一可见颗粒的常规、可靠检测(≥70%PoD)的阈值通常接近直径150μm【4】,对于直径200μm或更大的颗粒,通常超过95%。相同长度的纤维的PoD比上面讨论的球形颗粒的PoD要小,可靠的检测通常开始于500μm或以上。因此,在一个合格的视觉检测系统中,绝大多数可能未被检测到并被引入药品供应链的非纤维颗粒将小于200μm。改变容器(如增加大小和不透明度),配方(如颜色和澄清度),填充水平和颗粒特性超出大小(如。例如,颜色,形状和密度)都会影响特定产品和包装的PoD【6】。
2.2患者风险
对医学文献的完整回顾超出了本章的范围,但颗粒对病人的影响必须被考虑。这里有关于这个问题的一些评论【7-13】。注射剂中的微粒物质的临床意义是由许多因素决定的,包括微粒的大小和数量、材料的组成、微生物污染的可能性、给药途径、预期的病人人数和病人的临床状况。例如,一个健康的人接受含有无菌惰性微粒的皮下注射或肌肉注射时,可能不会出现不良反应,或者最坏情况下会出现小的肉芽肿。另一方面,危重早产儿通过脐带导管直接接受含颗粒输液可能会产生相当大的病理生理后遗症【14,15】。
Garvin和Gunner是第一批报告此类事件并对粒子对人类患者的影响表示担忧的人【16,17】。由于明显的伦理原因,目前缺乏关于颗粒对人类患者影响的对照临床研究。
一些关于人类患者安全的轶事信息可以通过检查静脉注射药物滥用者的病例报告获得【18-20】。在这种情况下,固体口服剂量通常磨碎并作为浆液注入;肺异物栓塞和肉芽肿在这些病人中可见【21】。不幸的是,由于不溶性颗粒的极端数量和不可控的使用条件,很难从这些观察结果中推断出少量颗粒对人类患者构成的临床风险。
已经进行了大量的动物研究来确定不同大小和组成的静脉微粒的影响【22-25】。大多数研究都集中在直径小于50μm的亚可见粒子上。在这些研究中,大剂量的颗粒灌后,能够检测到伴有肺毛细血管内皮细胞损伤【26】、肺毛细血管显微血栓【27】、肺显微肉芽肿【28】和肝致炎效应【29】等的组织学证据。虽然这些研究有助于人们了解颗粒物的病理生理反应,但这些研究中使用的大剂量颗粒物(例如,每千克注射10个颗粒物)并不能说明少量宏观颗粒物对人类构成的风险。动脉栓塞使用的材料,如聚乙烯醇(PVA)、胶原涂层丙烯酸微球以及明胶球,也提供了一些深入的潜在的人类病理生理学意义的非目标栓塞的静脉外颗粒输液。在这些病例中,也有报道称大剂量颗粒载荷从动脉注射部位移动到静脉循环中【30-34】。
在一篇关于粒子注射危害的评论中,已经发现:小瓶中颗粒物的主要来源是穿刺落屑,这种风险几乎每一次注射都存在。此外,病例报告也记录了与注入大量沉淀外加剂或使用颗粒进行栓塞治疗相关的损伤【14、15、35】。尽管每年注射药物的剂量估计为150亿剂【36】,但没有发现与注射单个可见颗粒相关的不良事件的报告。最终,必须对每种药物产品、预期患者群体和给药方法进行与注射中的颗粒物相关的安全考虑。没有一套单一的检查标准能够充分预测对病人的所有潜在风险。< 790 >中概述的方法应作为评估目视检查程序是否适当时的基本要求,但当患者群体和产品的预期使用需要采取这些额外措施时,应实施替代验收标准(例如,加严抽样计划的使用)。
2.3
要求注射剂是“真溶液”的提法,出现在1915年的《美国药典》第九章中;也在1936年版的美国国家处方集的第四章用于注射剂的“溶液澄清度”中,第一次出现。从那时起,在这方面对概要作了许多修改。在药典论坛(37)中可以获得关于药典检验标准的全面历史。
3.典型检验工作流程
3.1 100%检验
第< 790 >章建立了期望,作为常规制造过程的一部分,每个单元的注射剂产品都将被检查。检查应在最容易发现缺陷的时间和地点进行;例如,在设备或组合产品上贴标签或装盒之前。每个单元都可以用肉眼进行人工检查,或使用传送带运输并将容器传递至人工检查人员(半自动检查),或使用光线遮蔽法(LO)或电子图像分析(自动化检查)检查。手动和半自动检验只能由经过培训的合格检验员进行。还可以通过使用同时容纳多个单元进行检查的装置来增强检查能力。这种检查可以在线进行,也可以与灌装或包装一起在线进行,也可以在单独的离线检查部门进行。这个检查的目的是检测和清除任何观察到的缺陷。当有疑问时,该单元应该被移除(参见图1)。
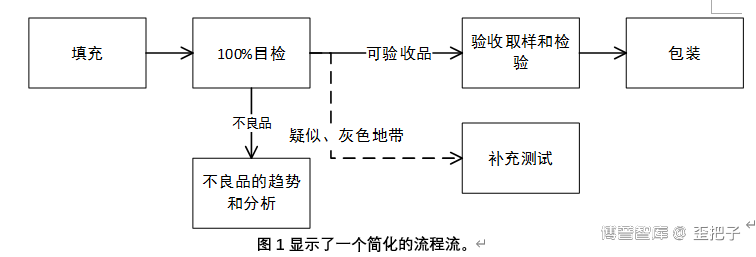
可能需要其他的策略,如重新检查或两阶段检查,并在3.3补救和备选做法中加以讨论。
【注: 100%检查是指对容器密封系统及其内容物的完整检查。检查可以在单一操作中完成,也可以采用多种技术组合在多个步骤中完成。参见3.3补救和替代措施中的额外讨论和6.检查方法和技术。】
【注:当产品或容器的性质限制了对内容物的目视检查时(例如,用冻干粉针或粉末,或用茶色玻璃或不透明容器),需要进行补充试验。参见5.2独特产品和容器注意事项中的额外讨论。可以从100%检验后的任何工艺过程节点提取补充测试的样品。 】
在100%检验期间,应确定典型不合格率的界限,以识别非典型批【38】。这些界限可以以缺陷的类别(例如,关键的,主要的,和次要的)或者以特殊类型的缺陷(例如,粒子)建立。回顾过去的工艺制程对确定这些界限是有用的,回顾可以包括对外观和制造上相似的产品进行分组。建议对这些界限进行定期重新评估,以考虑预期的工艺改进和/或工艺基线的正常波动【39】。如果超过了界限,就应该启动调查。调查可以包括额外检查,也可以确定是否需要额外检查。
3.2验收抽样和测试
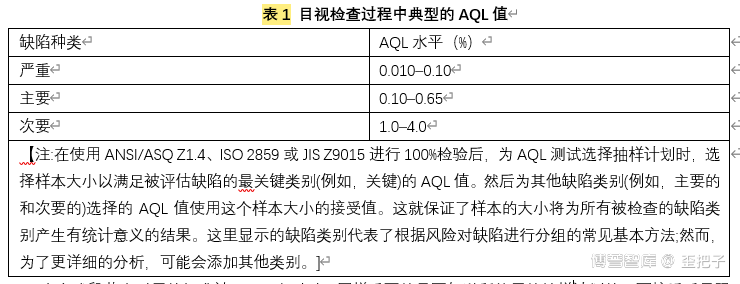
100%检验后,从检验过程所接受的单元中抽取有统计学意义的样品。这些取样的单元应由训练有素的检查员在受控条件下进行人工检查。第< 790 >章提供了为达到此目的的参考检验条件。样品可以是随机的,也可以是有代表性的(例如,固定的时间间隔或每个托盘固定的数量)。缺陷可能不会均匀地分布在批次上,因此需要一个代表整个批次的抽样过程。用于此目的的典型抽样计划可以在ANSI/ASQ Z1.4标准【40】中找到。在ISO 2859【41】或JISZ9015【42】标准中也可以找到类似的方案。对于批放行,通常使用常规II所列的抽样计划。当观察到非典型结果或进行复检时,加严抽样计划是合适的。这些计划规定了批次大小范围内的样品大小,并要求选择可接受的质量限(AQL)。AQL是接收质量限的缩写,即当一个连续系列批被提交验收时,可允许的最差过程平均质量水平(原文:AQL是指95%被检验的批次被接受的不良率,是误拒绝接收合格批次的量度)。关键缺陷(那些对病人构成最大风险的缺陷)应该被分配一个非常低的价值的AQL。通常,一个关键缺陷的接受数量(样品中允许的缺陷单元的数量)是零。主要和次要缺陷,对病人的风险较小,将有增加的(不那么严格的)AQL值和接受大于零的结果。关于缺陷分类的进一步定义和讨论见5.1缺陷类别。表1显示了通常用于目视检查过程的AQL值的范围【43】。
当上述段落中引用的标准被AQL索引时,同样重要的是要知道所使用的抽样计划的不可接受质量限(UQL)。这些可以在这些标准中为每个计划提供的运行特性(OC)曲线数据中找到,也可以在使用合格软件独立计算的数据中找到。还应该知道所使用的抽样计划的UQL。UQL是90%被检查的批次将被拒绝的不合格率,它是对客户或患者风险的更好度量。任何采样计划所提供的保护由其OC曲线表示。这是一个批次接受概率与批次中的缺陷率的曲线图。AQL和UQL是这条曲线上的两个点。取样的单元应由训练有素的检查员在受控条件下进行人工检查。检验条件应符合100%检验过程。
人工验收取样应在任何类型的100%检验过程后进行,包括人工、半自动化和自动化检验过程。与预定义的验收标准相比,它提供了对整个检验过程的性能和特定批次的质量的度量。虽然自动化系统在使用前已经过验证,并经常接收挑战以确保可接受的性能,但人工验收抽样检查的使用发现了未包括在开发和培训自动化系统的人工检查过程中的意外缺陷。
验收标准包括产品质量标准和验收/拒收标准,例如AQL和UQL值,基于《21 CFR》210.3【44】中所述:为决定接受或拒绝一整批或一批次产品(或任何其他方便的制造单元的子组)所必需的相关抽样计划。如不符合抽样计划的验收标准,应进行调查。根据失败的性质,这项调查应该包括对颗粒的法医分类/鉴定,以及对生产过程、原材料和包装材料的检查,以及检查过程。如果在调查后,检验过程被认为有能力发现有问题的缺陷,这批货物可以重新检验。还可以选择更适合于检测特定缺陷的替代检查过程进行重新检查。在复检后(对该批产品进行第二次100%的复检),对已接受的产品抽取新的样品,并与已建立的验收标准进行比较。在这种情况下,使用加严抽样计划和验收标准是一个很好的做法,因为这个过程步骤的非典型性。

