背景
质量文化在制药生产运营中一直很重要。强大的公司知道这一点,并在系统和人员方面投入资源,以支持和促进对质量过程、产品质量和满足患者需求的关注。最近,卫生当局更加重视质量文化,将其纳入指导文件和检查方案,如PIC/S数据完整性指南【1】, FDA新检查方案项目(NIPP)【2】, MHRA数据完整性指南【3】。
ISPE和PDA都开发了信息和资源,帮助制药公司更好地理解为什么质量文化是重要的,以及如何评估一个站点或组织的当前状况。ISPE文化卓越报告【4】分享了质量文化改进的六个维度的愿景,利用了19个行为文化成熟度评估,概述了一系列的实践和工具来支持实施,并为希望在组织内部建立健康优质文化的公司提供了一个实用的参考框架。PDA质量文化评估程序【5】基于包含21个质量文化度量的成熟度模型,并为评估人员提供培训,PDA -管理所有员工调查,并访问综合基准测试结果,以便与其他场地进行比较。通过使用上述任一方法,公司都可以在自己的文化中识别出需要改进的领域,并确定其优先级。许多公司都有特定的文化和质量体系评估过程,这些过程是他们在内部开发的,并将受益于使用参考指南来推进特定框架元素的成熟度。
ISPE和PDA文化工作组的成员共同开发了这一参考指南,确定了质量体系和文化的具体方面,并对工具、技术和过程提出了建议。本指南的目的不是提供任何工具的完整培训或实施,也不是一份包罗万象的清单;相反,本指南旨在作为一个资源,提供到最常用工具的附加信息的链接。本参考指南中包括的工具是免费的。不同的方法或工具可能更适合于某些问题或情况,本指南的每个用户都可以决定在每种情况下哪种方法最有效。
该指南分为两个部分:根本原因分析工具和方法,以及人为错误分析工具和方法。
任何希望对本指南的未来版本做出贡献或提出其他主题的人,请通过ask@ispe.org或info@pda.org联系ISPE的会员服务。
最后,虽然目前许多CAPA系统的重点是重大的违规行为,但也应该考虑主动将这些技术应用于较小的不符合或OOT事件,这些事件往往会给产品质量带来风险、浪费时间和金钱——或更重要的是——错过了研究的机会。此外,谁也不能保证这些较小的事件不会在未来某个时候在不利的情况下再次发生,并带来更严重的后果。我们希望:你会发现这本实用指南不仅简单易用,而且在下述领域是有用的:在应对管理中遇到的诸多变异源的挑战中提供持久的解决方案。
作者团队
Tami Frederick, Perrigo (负责人)
Denyse Baker, AstraZeneca
Nuala Calnan, Biopharm Excel
Steven Mendivil, Amgen
Matt Pearson, Genentech Roche
Brianna Peterson, Boehringer-Ingelheim
根本原因分析指南:引言
本杰明•富兰克林(BenjaminFranklin)的格言“一盎司的预防等于一磅的治疗”,为制药行业提供了一条途径,可以加强文化基础,这些文化基础支撑着每天为患者提供高质量产品的价值观和行为。一个组织中成熟文化的标志是,当失败和偏差出现时,它能够应对其复杂性。同样重要的是,它是否主动评估潜在风险以防止故障或重复出现的偏差,还是在故障发生后反应性地检测和纠正故障。21世纪的药品质量体系(PQS)需要一种更加平衡的方法来预防和控制偏差。纠正和预防措施(CAPA)系统旨在实施和记录纠正和预防措施。ICH Q10进一步推荐了有效的CAPA流程:
应采用结构化的调查方法,以确定根本原因。调查的努力程度、形式和文件应与风险水平相称,符合ICH Q9。CAPA方法应引发产品和工艺改进,增强产品和工艺理解【6】。
本实用参考指南旨在支持组织对其调查过程实施更结构化的方法,从而增强患者安全并为企业带来价值。RCA是确定问题的根本原因,以确定适当的纠正或预防措施的过程,它是任何组织的持续改进计划的重要组成部分。在CAPA系统中遇到的一个常见问题是,在识别故障事件的真正根本原因方面缺乏精确性。这导致的情况是,确定和纠正某一特定失败的影响或因果因素(那些可以潜在地预防该事件或减轻其后果的因素),而不是根本原因。这些故障症状往往更明显,也更容易报告,而问题的实际根本原因可能被淹没、未获知,因此问题没有得到根本解决。不足为奇的是,这通常会导致在组织的随机时空再次出现失败。
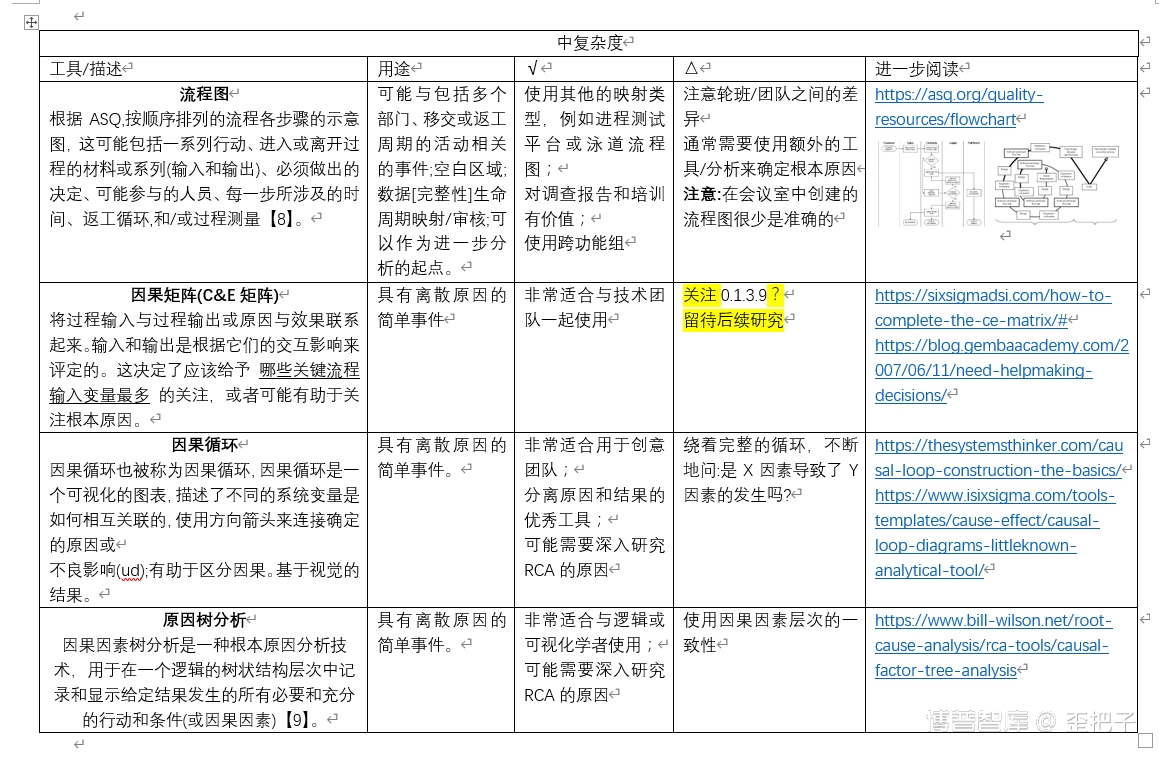
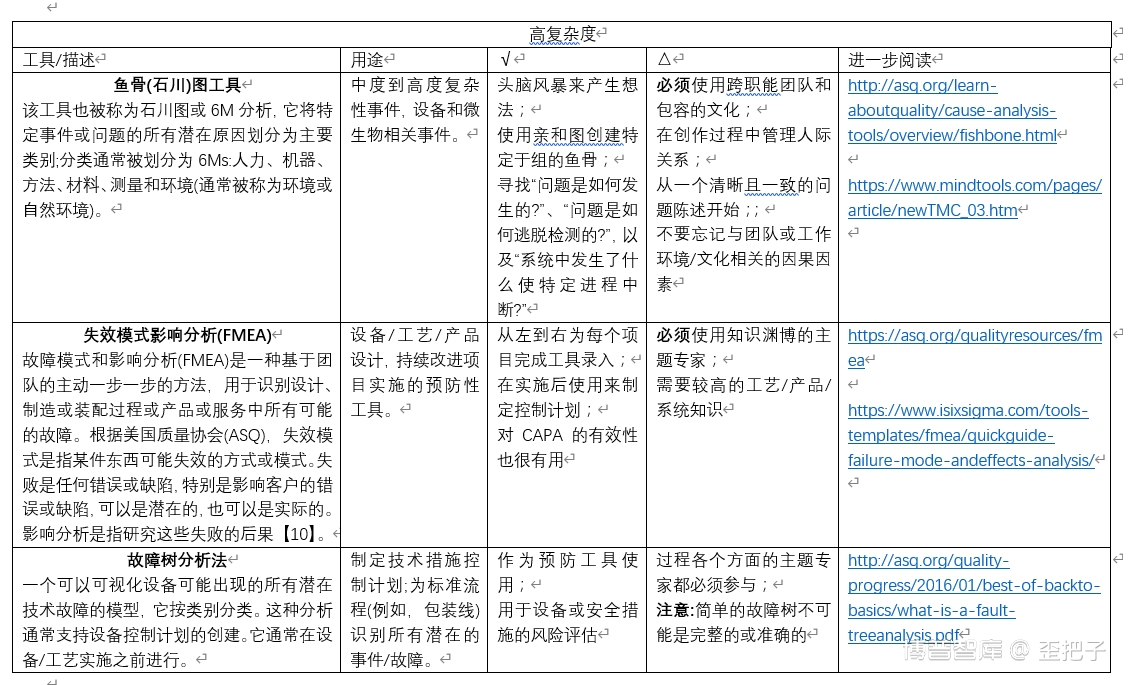
RCA是一个系统的解决问题的过程,挖掘这些根本原因,应用持久的解决方案。有效的RCA需要应用批判性思维,在组织、场地甚至轮班中应用多学科知识探索方法。为了帮助制药公司改进他们目前解决问题的方法,ISPE和PDA合作收集了一系列RCA工具,这些工具可以用于寻找真正的根本原因。工具十八般,样样不同,熟悉这些工具可以培养使用它们的技能。
不同的方法或工具可能更适合于某些问题或情况。因此,由本指南的每个用户来决定在每种情况下哪种方法最有效。在许多情况下,RCA工具的组合将提供最全面的结果。另一个最佳实践是公司选择一套工具,不超过六个,反复使用这些工具来建立专业知识和结果的一致性。
这并不是一个包含所有内容的列表,而是重点介绍许多常用的方法,并就如何以及何时使用每种方法提供指导。本指南中的工具是根据所包括的每个工具的难度等级排列的。它们是免费的。本文介绍宝贵经验的同时,也提供了一个的链接,以了解具体经验的形成。为此,指南中描述的每一个RCA工具或技术都附带了最佳应用的建议(标记为√号)和使用时的注意事项或特殊考虑(标记为△号)。还包括到进一步讨论和资源的链接。

人为错误分析工具和方法
在调查问题或偏差的根本原因时,分析经常指向人为错误。虽然人们很容易就此打住,并加入诸如“重新培训操作员”或“更新SOP”等对策,但人类的表现本质上是可变的,并取决于环境的条件,这意味着这些工具和方法不太可能带来长期、稳定的解决方案。
在任何给定的过程或问题中,都应该更深入地分析错误背后的人为因素。人为错误不应该是根本原因调查的结论,而应该是出发点。这种分析还应该包括对子团队、工作组或组织的文化的全面理解或评估。研究表明,环境的压力或复杂性会增加犯错的频率。一旦充分理解了人为因素,就可以采取诸如防错、防错或相关工程解决方案等行动,以减少人为错误的潜在风险。下面列出了一些可以帮助进行分析和改进的资源和工具。

参考文献
1. Pharmaceutical Inspection Convention, PharmaceuticalInspection Co-Operation Scheme. “Good Practices for Data Management andIntegrity in Regulated GMP/GDP Environments PI 041-1 Draft 3, 30 November 2018.”https://picscheme.org/layout/document.php?id=1567
2. Gottlieb, S. “Statement from FDACommissioner Scott Gottlieb, M.D., on new steps to strengthen and modernizeagency’s oversight and reporting of inspections forsterile injectable drugs.” 9 November 2018. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm625601.htm
3. Medicines Healthcare product Regulatory Agency. “ ‘GXP’ Data Integrity Guidance and Definitions Revision 1 , March 2018. ”https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/687246/MHRA_GxP_data_integrity_guide_March_edited_Final.pdf
4. International Society for Pharmaceutical Engineering.2017. “ISPE Cultural Excellence Report.” https://ispe.org/ImproveCulture
5. Parenteral Drug Association. “PDA Quality CultureTransformation.”
https://www.pda.org/global-event-calendar/courses/pda-qualityculture-transformation
6. International Conference on Harmonisation of TechnicalRequirements for Registration of Pharmaceuticals for Human Use. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q10/Step4/Q10_Guideline.pdf
7. Wilson, W.J. “Barrier Analysis.” TheRootisserie
http://www.bill-wilson.net/root-cause-analysis/rca-tools/barrier-analysis
8. American Society for Quality. n.d. “What is a Flowchart?”
https://asq.org/quality-resources/flowchart.
9. Wilson, W.J. “Causal Factor TreeAnalysis.” The Rootisserie
https://www.bill-wilson.net/root-cause-analysis/rca-tools/causal-factor-tree-analysis
10. American Society for Quality. n.d. “Failure Mode EffectsAnalysis (FMEA).”
https://asq.org/quality-resources/fmea
11. Mulder, P. (2018). “Poka Yoke.” Retrieved 12 April 2019 from ToolsHero:
https://www.toolshero.com/quality-management/poka-yoke/
12. Bridges, W.G., Ginette Collazo-Ramos. (2012). “Human Factors and theirOptimization.” Process Improvement Institute, Inc.
http://www.process-improvement-institute.com/_downloads/Human_Factors_and_their_Optimization_website.pdf.
13. Fader, S. (2019). “Understanding theAntecedent Behavior Consequence Model.” BetterHelp. https://www.betterhelp.com/advice/behavior/understanding-the-antecedent-behavior-consequence-model/
工具的参考书目
ASQ.org. “Failure Mode and Effects Analysis(FMEA).” [Online]. Available from https://asq.org/quality-resources/fmea.
ASQ.org. “Fishbone Diagram.” [Online]. Available from https://asq.org/quality-resources/fishbone
ASQ.org. “What is a Flowchart? [Online].Available from https://asq.org/quality-resources/flowchart
ASQ.org. “What is an Affinity Diagram? [Online].Available from: https://asq.org/quality-resources/affinity
Bialek, Ron, Grace L. Duffy, and John W. Moran. “Five Whys and Five Hows.” Quality in Healthcare [Online]. Available from http://asq.org/healthcare-use/why-quality/five-whys.html
Bridges, William G., Ginette Collazo-Ramos (2012). “Human Factors and their Optimization.Process Improvement Institute.” Process ImprovementInstitute.
[Online]. Available from:
http://www.process-improvement-institute.com/_downloads/Human_Factors_and_their_Optimization_website.pdf
Fader, Sarah. (2019). “Understanding theAntecedent Behavior Consequence Model.” BetterHelp.[Online]. Available from
https://www.betterhelp.com/advice/behavior/understanding-the-antecedent-behavior-consequence-model/
Forest, George. “Quick Guide to FMEA(Failure Mode and Effects Analysis).” ISixSigma.[Online]. Available from https://www.isixsigma.com/tools-templates/fmea/fmea-quick-guide/
Lannon, Colleen. “Causal Loop Construction:The Basics.” The Systems Thinker. [Online]. Availablefrom https://thesystemsthinker.com/causalloop-construction-the-basics/
MindTools.com. “5 Whys.” [Online]. Available from: https://www.mindtools.com/pages/article/newTMC_5W.htm
MindTools.com. “Cause and Effect Analysis.” [Online]. Available from: https://www.mindtools.com/pages/article/newTMC_03.htm
Mulder, P. (2018). “Poka Yoke.” ToolsHero [Online]. Available from:
https://www.toolshero.com/quality-management/poka-yoke/
Pereira, Ron. (2007). “The Cause & EffectMatrix.” GEMBA Academy. [Online]. Available from https://blog.gembaacademy.com/2007/06/11/need-help-making-decisions/
Pilot, Shima. (2016). “What Is a Fault TreeAnalysis?” Quality Progress. [Online]. Available from:
http://asq.org/quality-progress/2016/01/bestof-back-to-basics/what-is-a-fault-tree-analysis.pdf
SixSigmaDaily.com. (2012). “The Affinity Diagram Tool.” [Online]. Available from:
https://www.sixsigmadaily.com/the-affinity-diagram-tool/
SixSigmaDSI. “How to Complete the Causeand Effect Matrix.” [Online]. Available from:
https://sixsigmadsi.com/how-to-complete-the-ce-matrix/#
Rushing, William. “Causal Loop Diagrams:Little Known Analytical Tool.” ISixSigma. [Online].Available from: https://www.isixsigma.com/toolstemplates/cause-effect/causal-loop-diagrams-little-known-analytical-tool/
Wilson, Bill. (2014). “Causal Factor TreeAnalysis.” The Rootisserie. [Online]. Available from:
https://www.bill-wilson.net/root-cause-analysis/rcatools/causal-factor-tree-analysis
Wilson,Bill. (2015). “Barrier Analysis.” The Rootisserie.[Online]. Available from:
http://www.bill-wilson.net/root-cause-analysis/rca-tools/barrier-analysis

