本周主要法规主要内容为我国疫苗监管体系通过世界卫生组织评估、执业药师考试、国外核查、连续制造、公务公开、处转非和一致性评价相关内容:
1、我国疫苗监管体系通过世界卫生组织评估
2022年8月23日,世界卫生组织(WHO)宣布中国通过疫苗国家监管体系(NRA)评估。这表明我国疫苗监管体系得到了世界范围内的认可,后续相关企业只有通过国家监管体系评估,才能申请WHO疫苗产品预认证,才能列入联合国等国际组织采购清单。
2、湖北药友请注意
2022年8月24日,湖北省药监局发布“关于2022年度执业药师职业资格考试工作的通知”。
2.1.该通知规定自2022年起,执业药师职业资格考试工作年限要求调整如下:
2.2.具体时间安排:
2.3.考试收费标准:
3、比利时一家公司注射浓溶液产品有效期与注册批准有效不一致
2022年8月22日,国家药监局发布对比利时UCB Pharma S.A.组织开展药品境外非现场检查的结果。
3.1.产品名称:左乙拉西坦注射用浓溶液(进口注册证号:H20170341,规格5 ml:500 mg,商品名开浦兰)。
3.2.检查缺陷:该品种部分批次产品标示的有效期与注册批准的有效期不一致。
3.3.检查结论:该品种生产不符合我国《药品生产质量管理规范(2010年修订)》要求。
3.4.处理措施:为保障公众用药安全,根据《中华人民共和国药品管理法》有关规定,国家药监局决定,自即日起,暂停该产品在中国境内进口、销售和使用,并对相关问题依法调查处理。各进口口岸药品监督管理部门暂停发放该产品的进口通关凭证。
4、今年年底或将实施ICH《Q13:连续制造》指导原则
2022年8月19日,药审中心以线上线下相结合的方式召开了ICH Q13指导原则专家研讨会,大会指出了实施该指导原则可能存在的问题并进行了充分讨论。
4.1.ICH《Q13:连续制造》指导原则进展情况
4.2.什么是连续制造
4.3.连续制造有什么意义
4.4.国内对连续制造的认识
4.5.国内哪个监管机构最了解
4.6.后续将有哪些动作
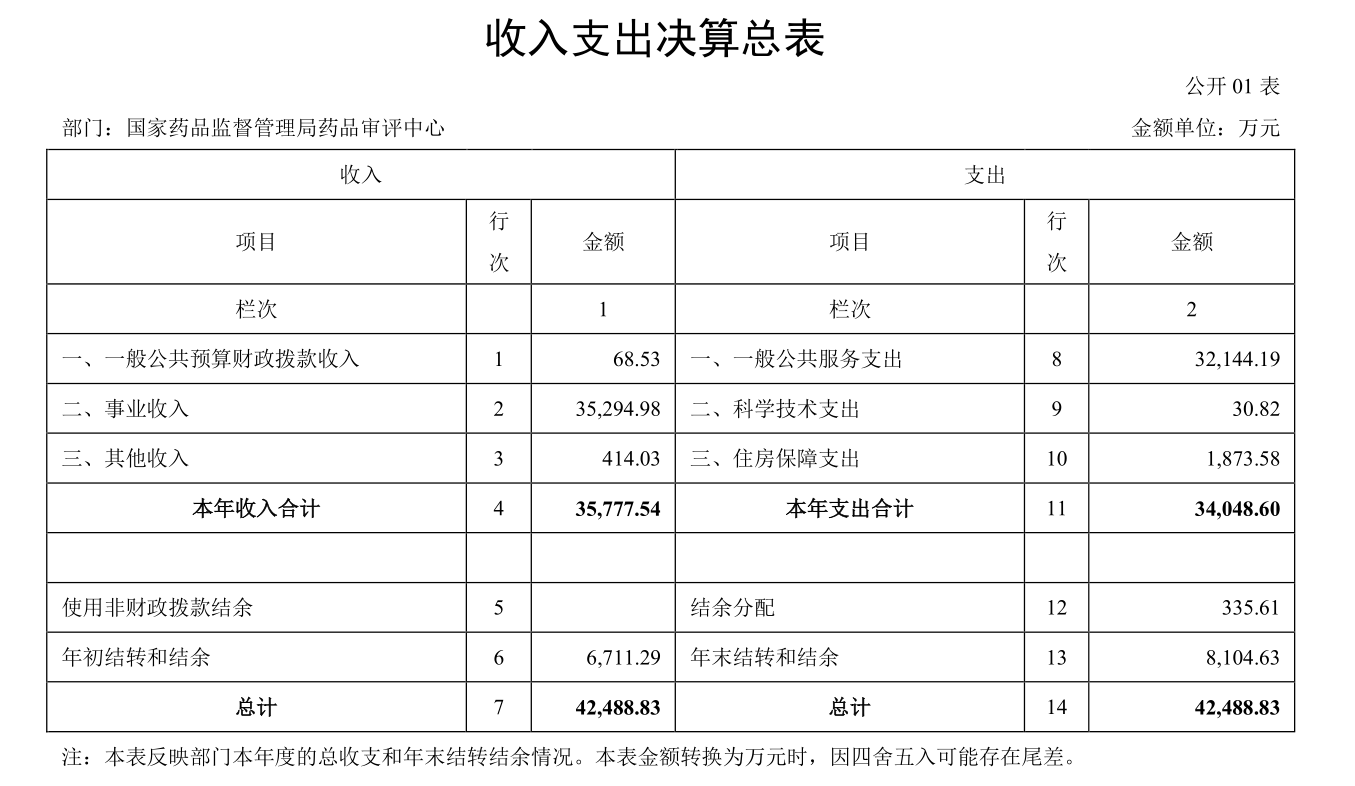
5、药审中心2022年收入约3.6亿,整体收支平衡
2022年8约25日,药审中心按照国家药监局有关工作要求,依法依规履行公开主体责任和义务,公开发布了《国家药品监督管理局药品审评中心2021年度部门决算》。
6、奥美拉唑肠溶片药品上市许可持有人请注意
2022年8月25日,国家局发布奥美拉唑肠溶片由处方药转换为非处方药。
6.1.品种名单

6.2.非处方药说明书范本
【内容详细程度太过详尽,篇幅太大,请大家点击链接查看】https://www.nmpa.gov.cn/directory/web/nmpa/images/1661505299690030267.docx
6.3.修订说明书备案期限:
2023年5月24日前,向省级药品监督管理部门提交修订说明书备案
6.4.其他注意事项:
7、国家药监局发布仿制药参比制剂目录(第五十七批)
2022年8月25日,国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定仿制药参比制剂目录(第五十七批)。
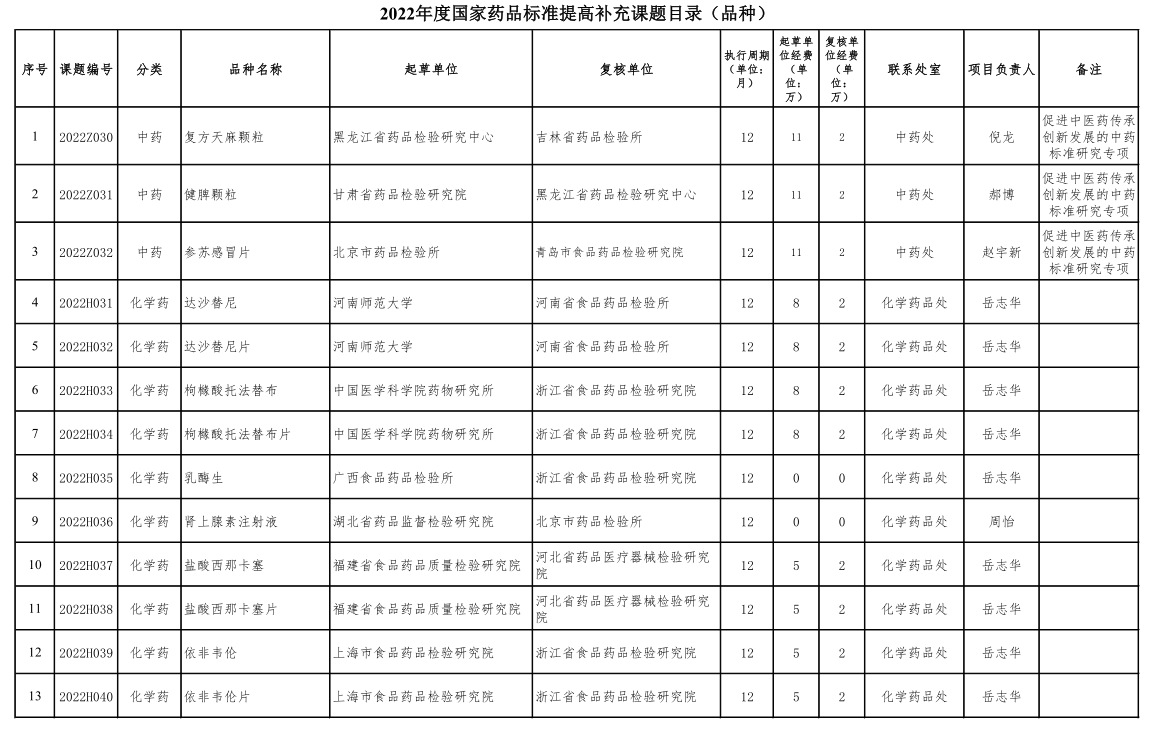
8、药典委公布第二批2022年度国家药品标准提高课题目录
8.1.2022 年度国家药品标准提高补充课题目录
8.2.2022 年度国家药品标准提高补充课题目录(通用技术要求)
8.2.1.中药
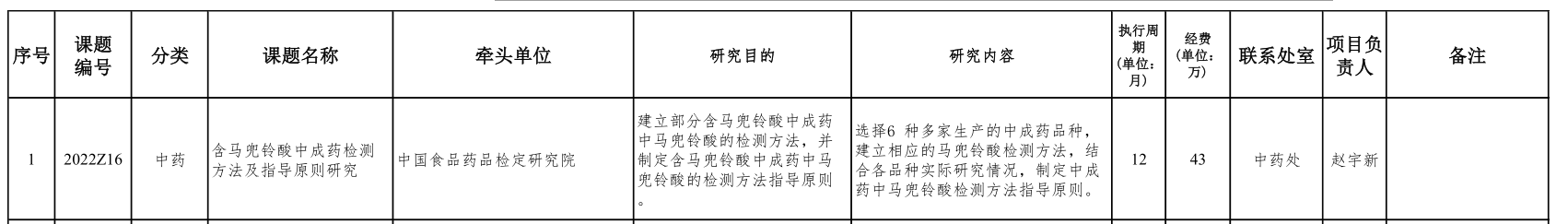
8.2.2.化药

8.2.3.生物制品

8.2.4.理化分析

8.2.5.微生物

8.2.6.药用辅料

9.某省药品监督管理局公开征求药物警戒检查指导细则
2022年8月26日,陕西省为推动本省药品生产企业及药品上市许可持有人药物警戒制度实施,指导药品监督管理部门规范开展药物警戒检查工作,根据有关法律法规文件起草了《陕西省药物警戒检查指导细则(征求意见稿)》,通知规定征求意见截止到2022年9月5日。

