一、文件施行通知
1. 2022-11-30 国家药监局关于规范药品网络销售备案和报告工作的公告(2022年 第112号)
根据《药品网络销售监督管理办法》的要求,为指导各级药品监督管理部门有序开展药品网络交易第三方平台备案和药品网络销售企业报告工作,现发布相关公告,公告内容包括药品网络交易第三方平台备案【备案资料、材料核对、变更备案、取消备案、数据送达】、药品网络销售企业报告两大内容。
2. 2022-11-30 国家药监局关于发布药品网络销售禁止清单(第一版)的公告(2022年 第111号)
为贯彻落实《中华人民共和国药品管理法》和《药品网络销售监督管理办法》要求,保障公众用药安全,国家药品监督管理局组织制定了《药品网络销售禁止清单(第一版)》,现予发布,自2022年12月1日起施行。

3. 2022-11-30 国家药监局关于发布《药品经营质量管理规范附录6:药品零售配送质量管理》的公告(2022年 第113号)
为加强药品经营监督管理,进一步规范药品零售配送行为,保障零售配送环节药品质量安全,根据《药品网络销售监督管理办法》和《药品经营质量管理规范》,国家药监局组织制定了《药品经营质量管理规范附录6:药品零售配送质量管理》,现予发布,自2023年1月1日起施行。
二、文件征求意见
1. 2022-11-28 关于公开征求ICH指导原则《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》意见的通知
ICH指导原则《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》现进入第3阶段征求意见。按照ICH相关章程要求,ICH监管机构成员需收集本地区关于第2b阶段指导原则初稿的意见并反馈ICH。现就该指导原则内容及中文译文翻译稿向社会公开征求意见。社会各界如有意见,请于2023年1月20日前通过电子邮箱反馈我中心。
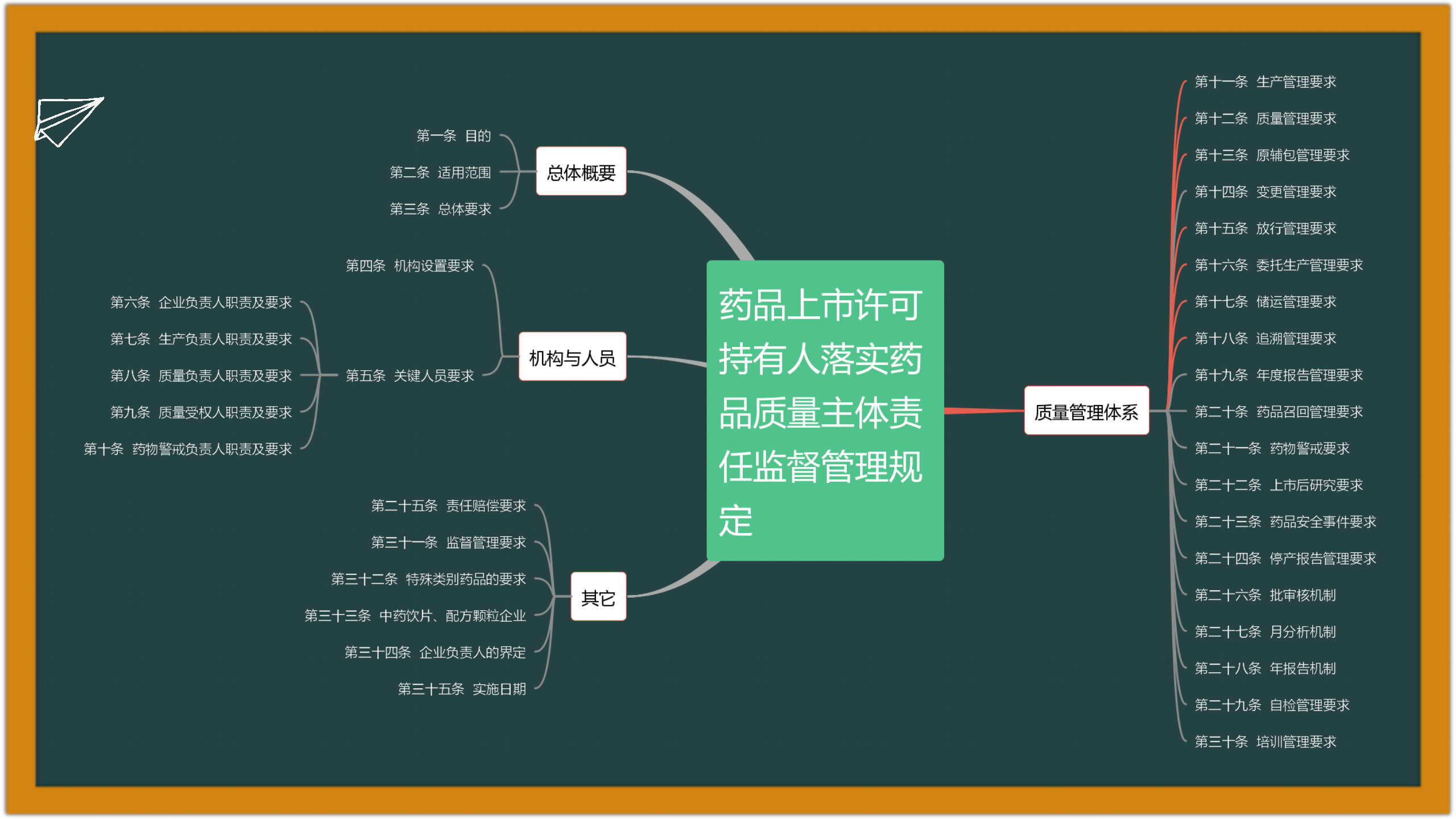
2. 2022-11-29 国家药监局综合司公开征求《药品上市许可持有人落实药品质量主体责任监督管理规定(征求意见稿)》意见
为督促药品上市许可持有人落实药品质量主体责任,进一步加强药品全生命周期质量监督管理,国家药监局组织起草了《药品上市许可持有人落实药品质量主体责任监督管理规定(征求意见稿)》,现向社会公开征求意见。请于2022年12月9日前,将有关意见反馈至电子邮件yaopinjianguan-2@nmpa.gov.cn,邮件标题请注明“落实持有人主体责任管理规定意见反馈”。
3.药典委连续发布征求文件
2022年11月29日、30日,12月01日,药典委连续分别发布了《 关于洋葱伯克霍尔德菌群检查法标准草案的公示》、《关于9201药品微生物检验替代方法验证指导原则修订草案的公示》、《 关于WHO INN P-List127及有关化学药品通用名称的公示》、《 关于微生物全基因组测序技术指导原则标准草案的公示》、《 关于细胞类制品微生物检查指导原则标准草案的公示(第二次)》、《关于体外热原检查法(报告基因法)标准草案的公示(第二次)》,为确保相关文件的科学性、合理性和适用性,现将拟修订文件征求社会各界意见。
三、通知公告
1. 2022-11-28 关于药审中心与中国药品监督管理研究会合作举办“新药非临床研究技术指导原则”线上培训的通知
关于药审中心与中国药品监督管理研究会合作举办“新药非临床研究技术指导原则”线上培训的通知:为进一步指导我国新药研发,加快新药研发上市进程,加强与非临床机构、研发企业的沟通交流,提升我国新药研发水平和效率,药审中心定于2022年12月8日举办“新药非临床研究技术指导原则”线上培训。
2. 2022-11-30 国家药监局关于实施药品注册申请电子申报的公告(2022年 第110号)
为提高药品审评审批效率,国家药监局决定药品注册申请申报资料实施电子形式提交:

3. 2022-12-01 国家药监局关于注销莪术油葡萄糖注射液等78个药品注册证书的公告(2022年第108号)
根据《中华人民共和国药品管理法实施条例》和《药品注册管理办法》的有关规定,国家药品监督管理局决定注销莪术油葡萄糖注射液等78个药品注册证书。
4. 2022-12-01 中药保护品种公告(第10号)(2022年 第109号)
根据《中药品种保护条例》的规定,国家药品监督管理局批准南昌弘益药业有限公司生产的达立通颗粒为首家中药二级保护品种,保护品种编号为:ZYB2072022005,保护期限自公告日起七年。
5. 2022-12-02 关于药品注册申请电子申报有关要求的通知

四、标准草案
1. 2022-11-29 关于羟苯磺酸钙国家药品标准草案的公示(第二次)
药典委拟修订羟苯磺酸钙国家药品标准,标准编号:《中国药典》2020年版二部。为确保标准的科学性、合理性和适用性,现将拟修订的羟苯磺酸钙国家药品标准公示征求社会各界意见(第二次)。公示期自发布之日起14天。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
2. 2022-11-29 关于尼群地平国家药品标准草案的公示
药典委拟修订尼群地平国家药品标准,标准编号:《中国药典》2020年版二部。为确保标准的科学性、合理性和适用性,现将拟修订的尼群地平国家药品标准公示征求社会各界意见(详见附件)。公示期自发布之日起3个月。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。
五、器械相关
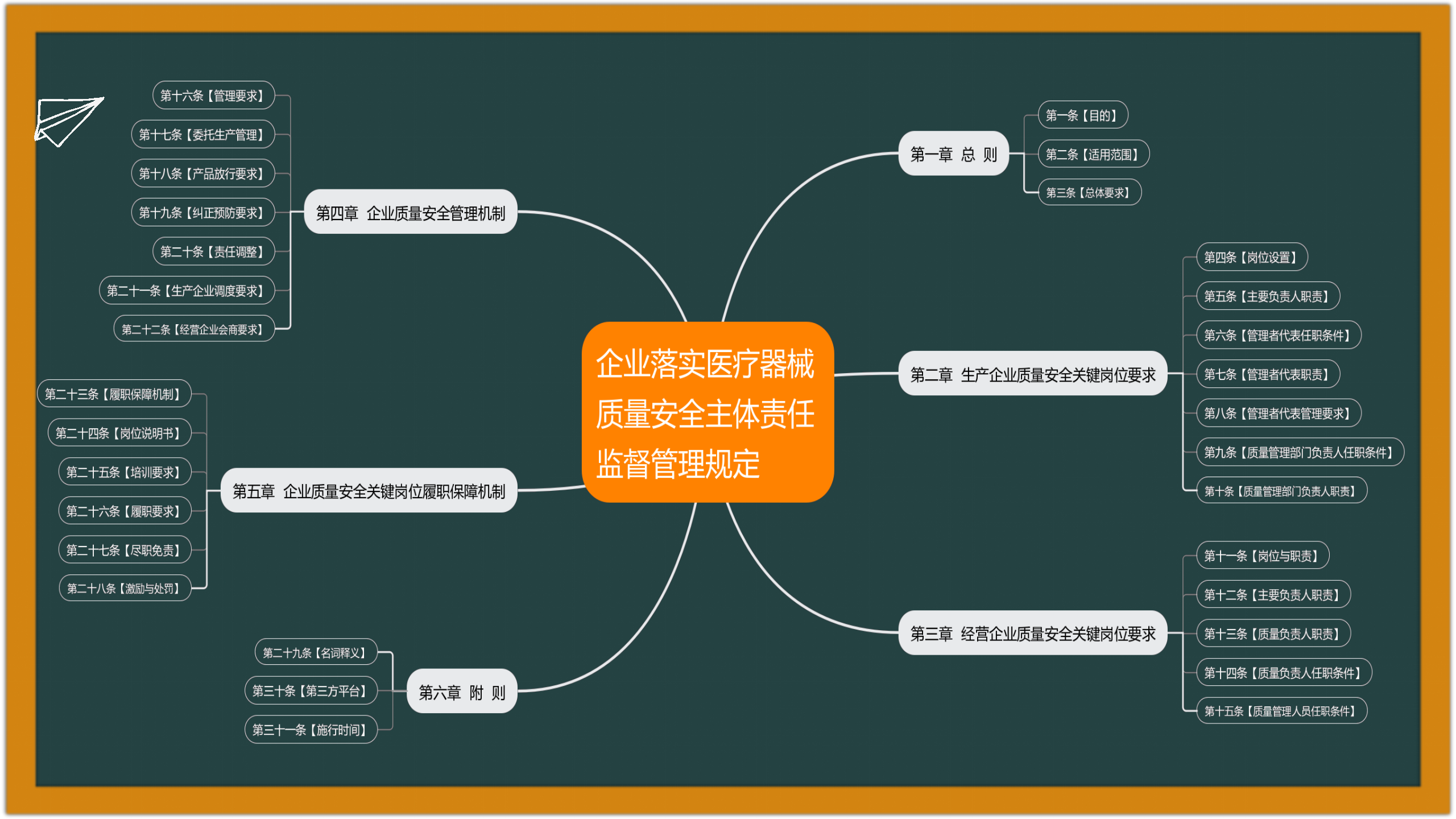
1. 2022-11-29 国家药监局综合司公开征求《企业落实医疗器械质量安全主体责任监督管理规定(征求意见稿)》意见
为督促医疗器械注册人、备案人落实医疗器械质量安全主体责任,强化医疗器械注册人、备案人、受托生产企业及经营企业质量安全关键岗位人员责任落实,国家药监局组织起草了《企业落实医疗器械质量安全主体责任监督管理规定(征求意见稿)》(见附件),现向社会公开征求意见。请于2022年12月9日前将有关意见反馈至电子邮箱zjfdaqxc@163.com。
2. 2022-11-30 国家药监局综合司公开征求《关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)》意见
为进一步贯彻落实《医疗器械监督管理条例》《国务院办公厅关于印发治理高值医用耗材改革方案的通知》和国务院深化医药卫生体制改革有关重点工作任务,推进医疗器械唯一标识在监管、医疗、医保等领域的衔接应用,国家药监局组织起草了《关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)》,现公开征求意见。请将修改意见和建议于2022年12月30日前反馈至电子邮箱:mdct@nmpa.gov.cn,邮件标题注明“UDI第三批实施”。
3. 2022-12-01 一次性使用压力监测磁定位射频消融导管获批上市
近日,国家药品监督管理局经审查,批准了上海微创电生理医疗科技股份有限公司生产的“一次性使用压力监测磁定位射频消融导管”创新产品注册申请。

