离子交换层析是生物大分子常用的分离技术之一,基于生物分子的电荷性质差异进行分离纯化的一种吸附型层析技术,通过生物分子所带的电荷与填料上所带的相反最荷的可逆相互作用来分离物质的一种层析方式。以常见的样品蛋白质举例,蛋白质是由氨基酸组成的,氨基和羧基在不同的pH环境下可以失去或获得质子,从而带上正电和负电。所以蛋白质的带电性质是高度依赖于pH的,首先每一个蛋白质都具有自己的等电点,就是此分子在某一个环境的pH下其净电荷为零,也就是带正电和带负电的量是相等的,这一pH值即为等电点。
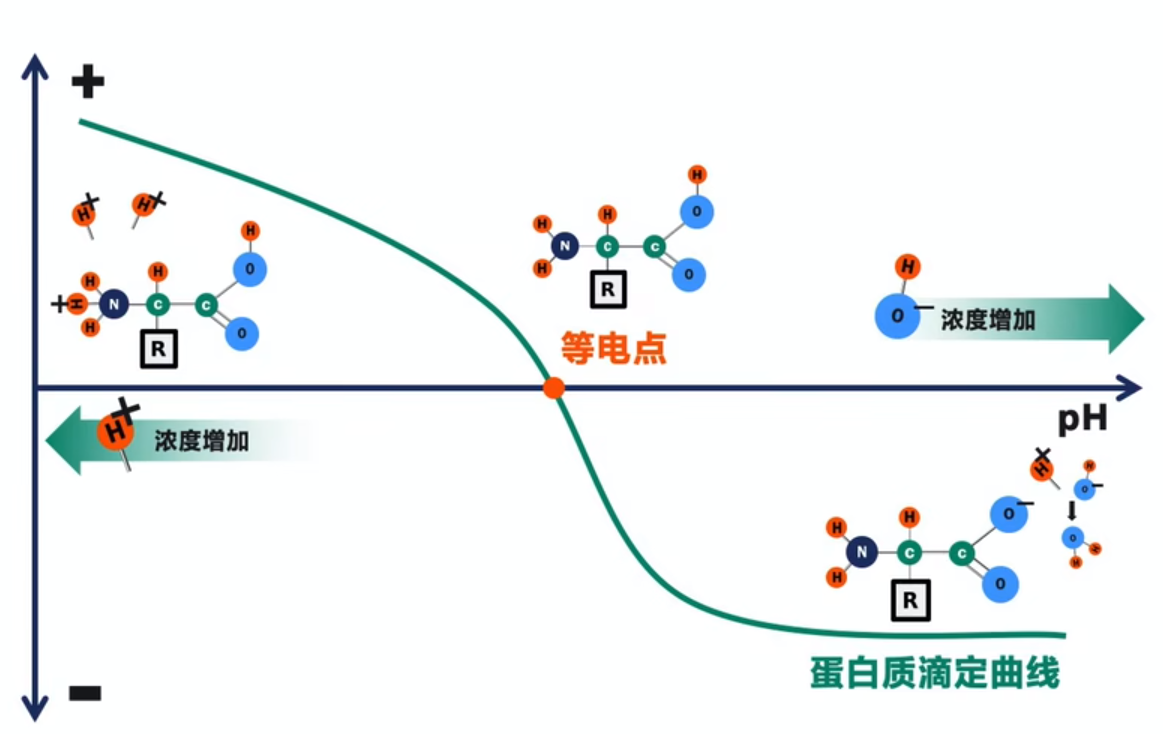
并且在不同的生物种属来源的蛋白质的等电点分布数据中我们可以看发现,大多数蛋白质的等电点会落在5-9之间。也就是说生理条件下蛋白质均具有电荷,如果目标蛋白等电点未知,可以利用这一特性先开始在中性条件下进行初筛试验,看它是带上正电还是负电。
离子交换层析技术具有如下特点,第一应用领域广,可以用来纯化任何带电的生物分子,不仅限于蛋白质,还可以应用于常见的多肽、核酸、多糖等,只要生物分子具有带电性质,就可以利用离子交换层析。第二分辨率高,针对性质较为接近的样品,如磷酸化与非磷酸化,甚至是差距是仅在一个氨基酸的样品之间也可以通过选择合适的填料,通常是高分辨率的离子交换填料和合适的工艺条件进行分离。第三其载量通常较高,甚至有的填料载量高达100mg/ml,但此时需要注意是,在实际的工艺过程中需要自行测目标样品的真实载量。高载量可以解决目前生物制药行业上游越来越大的表达量和规模对于下游的挑战。第四、因为离子交换无论是在层析的捕获还是中度纯化,还是精纯阶段,都具有不同规格和粒径大小的填料可供选择,并且不像凝胶过滤层析那样会受到样品处理量和流速对于产能的限制。也不会像亲和层析一样会引入标签造成不良反应的风险。并且其可控性相对较强,可以根据等电点和滴定曲线来控制生物分子带正电还是带负电,带有多少电荷都可以控制,所以可以广泛用于工业生产及实验室的各个层析阶段和规模中,是目前最常用的层析技术之一。
但是需要注意的是,虽然离子交换层析具有众多的优势,但如果想要获得高是产品质量和加收率,需要不断去做工艺摸索,寻找符合目标产品最佳试验条件。
大多多数离子交换层析分为四个阶段,平衡、上样与清洗、洗脱和再生,第一步是将固定相平衡到所需的起始缓冲液条件,当达到平衡时,所有固定相电荷基团与可交换的抗衡离子结合。第二步上样与清洗,目的是结合目标分子,并洗掉所有未结合物质,样品缓冲液应具有相同的PH值和离子强度,以便结合所有带与固定相基团相反电荷性质的蛋白质。第三个步骤洗脱,通过改变缓冲液的组成释放上一步骤中结合的生物分子,常用的方法是通过增加氯化钠或其它盐的浓度来增加离子强度,使结合的蛋白质脱落下来。生物分子的洗脱顺序与表面电荷基团的数量有关。最后一步是填料的再生,需要除去所有仍然结合在填料上的分子,确保其在下一次离子交换层析实验中依然保持较高的裁量。
缓冲液的选择,不同的pH下蛋白质的带电性和带电量都会发生变化,选择一个最佳的pH实验条件可以提高选择性,对于离子交换来说,蛋白质的电荷性质是高度低赖于缓冲液的pH的,所以必须在前期摸索合适的pH条件。建议在阳离子交换实验起始pH值低于pi值的0.5-1pH值开始摸索,降低pH可以提高结合强度。阴离子交换实验起始pH高于pi0.5-1pH,增加PH可以提高结合强度。结合强度也不宜太高,过高在洗脱过程中需要更高的离子强度去进行洗脱,需要结合蛋白质pH的稳定区间和耐受范围去合理的选择pH。可以灵活的利用溶液pH的变化,决定实验是采用结合/洗脱模式还是流穿模式。只要能够达到分离目标都可以选择。
确定pH值后还需要选择合适的缓冲体系,建议采用非挥发型的缓冲体系,缓冲范围不要超过pka值的±0.5范围。起始浓度一般为20-50mM,减少杂质的吸附。但是在配置缓冲液过程中还需要注意配制方式的不同对于缓冲液pH值的影响。因为结合缓冲注和洗脱缓冲液差别只在于增加了洗脱缓冲液增加1M高浓度的盐。
有时候为了增加样品溶解性和稳定性,会在缓冲液中添加添加剂,有机试剂会增加pka值,增加甘油和醇类会造成粘度和背压的增加,会限制流速。去垢剂也是经常使用的,会影响填料载量,而且去垢剂在盐递度增加过程中会达到临界胶束浓度,超过临界胶束浓度CMC,去垢剂形成胶束导致紫外检测出现问题。

