写在前面的话:作为一个细胞质量控制的小白,对很多概念知其然不知其所以然,工作中难免事倍功半。以下分享个人对细胞生长生长曲线绘制学习心得供入门者参考。
一、为什么要绘制细胞生长曲线?
细胞生长曲线可以用于评价细胞的活力这是我最初从教材中找到的答案,请教同事知道可以用于确定传代时间等,零零散散的信息总让人感觉似是而非。直到看到《Culture of Animal Cells A Manual of Basic Technique and Specialized Applications》一书我才找到自己最满意的答案。
Measurements of cell proliferation rates are often used to determine the response of cells to a particular stimulus or toxin(参见24.3.3).Quantitation of culture growth is also important in routine maintenance ,as it is a crucial element for monitoring the consistency of the culture and knowing the best time to subculture (参见12.5.1),the optimum dilution,and the estimated plating efficiency at different cell densities。Testi-ng medium,serum,new culture vessels or substrates, and so forth, all require quantitative assessment. As with cell counting there are a number of different ways of determining cell proliferation using cell counting, plating efficiency, or labeling with radioisotopic precursors of DNA or antibodies to cell cycle specific proteins. Counting and plating may be seen as direct ,while labeling techniques are indirect as they infer cell proliferation from the expression of metabolic markers.
这段文字中对细胞生长曲线的用途做了较全面的说明。首先是检测细胞增殖状况可以用于评价外部条件对细胞增殖的影响或某些物质对细胞的毒性。其次可以用于服务于细胞的日常培养:评价细胞培养用培养基的一致性、确定最佳传代时间、确定最佳稀释比或评估不同接种密度下细胞的接种率(集落形成率)等。关于细胞扩增效率的研究有很多,其中基于培养的方法较为简便直接。
除了完善了细胞生长曲线这个拼图外,个人在书中关于细胞生长曲线还有以下收获:
1.细胞生长曲线用于评价各种化合物对细胞增殖的影响时需要分析整个曲线,而非单个时间点数据。
Cell counts after a few days in culture can also be used to determine the effect of various compounds on cell proliferation, but, at least in the early stages of testing, a complete growth curve is required (see Protocols 23.7−23.9), because the interpretation of cell counts at a single point in time can be ambiguous (模棱两可、有歧义)(see Fig. 23.10, day 7). Growth curve analyses, using cell counting, are feasible(可行的) only with relatively small numbers of samples, as they become cumbersome(难处理的) in a large screen, although automating growth curves in multiwell plates using image analysis (see Section 23.9.3 and Figs.23.11, 23.12) can make this feasible.
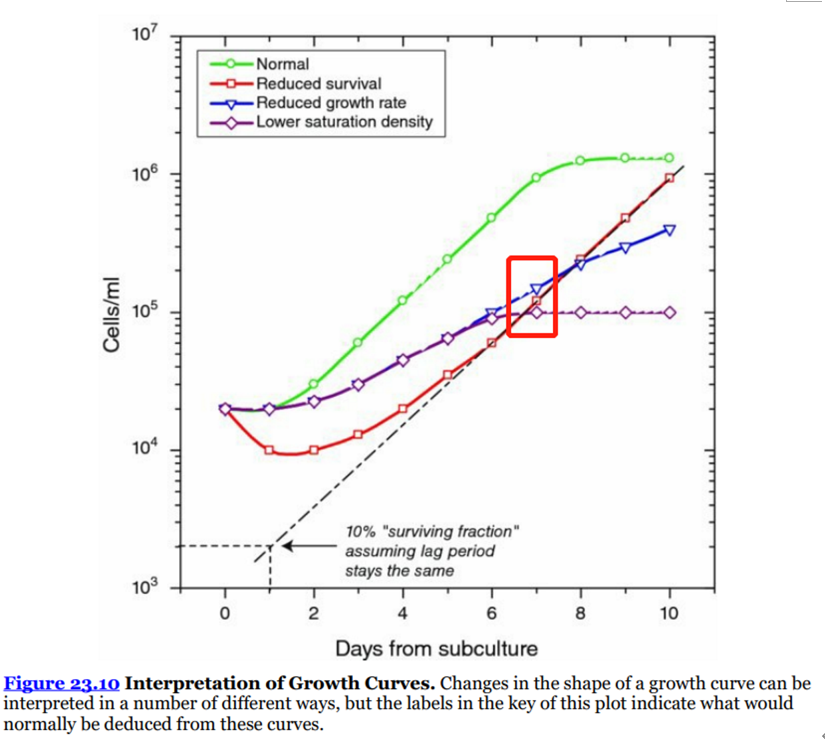
细胞生长曲线图1(来源于《Culture of Animal Cells A Manual of Basic Technique and Specialized Applications》,仅供学习交流用)
2.细胞生长曲线用于评价各种化合物对细胞增殖的影响时选择对数期时间点进行评价分析,单点的分析要基于完整的生长曲线进行对比分析。
In cases for which there are many samples, a single point in time (e.g., the number of cells 3−5 days after exposure) can be used. The time should be selected as within the log phase, and preferably midlog phase, of control cells. Any significant effect should be backed up with a complete growth curve over the whole growth cycle or by an alternative assay, such as a survival curve by clonogenic assay (see Protocol 24.3) or MTT assay (see Protocol 24.4).
3.细胞适应(细胞状态差或改变培养条件均会引起,如更换培养基)、细胞接种损失(部分细胞不贴壁或者死亡)、细胞密度低均会引起倍增时间降低。
4.关于细胞曲线绘制建议:
1)pH降低时更换培养基——保证充足的营养,及时换液或增加后期换液体积。
2)从板孔中间缓慢的加入细胞悬液避免形成涡旋导致细胞在边缘聚集;不要振摇混匀细胞,因为涡旋会导致细胞在中间聚集。
Add the cell suspension slowly from the center of the well, so that it does not swirl(形成漩涡) around the well. Similarly, do not shake the plate to mix the cells, as the circular movement of the medium will concentrate the cells in the middle of the well.
3)以细胞密度进行曲线绘制
Plot the cell density (cells/cm2) and the cell concentration (cells/mL), both on a log scale, against time on a linear scale
4)测试过程确定细胞分布是否均匀,细胞形态是否随着密度进行变化。
Examine the stained cells at each density to (a) determine whether the distribution of cells in the flasks or wells is uniform and whether the cells are growing up the sides of the well and (b) observe differences in cell morphology as the density increases.
5)选择6孔板优于24孔板,为克服边缘影响,可降低ml浓度增大接种体积。
Unfortunately, such a low volume would cause uneven cellular distribution due to the shape of the meniscus, and cells would tend to concentrate at the edges of the wells. This problem increases as the wells get sm-aller, because the relative effect of the meniscus increases with a decrease in diameter of the well. A reaso-nable compromise is to ensure that the cell density (cells/cm2 ) is the same, although the cell concentration will be less.
6)多孔板适用于条件选择比对;如果用于生产培养条件确认建议使用T25瓶
Multiwell plates are suitable for comparing different growth conditions, media, sera, or growth factors or cytotoxins, but if a growth curve is being used to establish conditions for routine maintenance then the growth curve must be performed in the same vessels as being used for routine subculture (although the difference between a 25-cm2 flask and a 75-cm2 flask will be minimal give that the volume of medium per cm2 remains the same).
二、绘制细胞生长曲线的那些细节
关于细胞贴壁细胞生长曲线的绘制可以参考司徒镇强老师的《细胞培养》一书。以下蓝字部分为个人理解。
1.取生长状态良好的细胞,对数期细胞。
如果只是对比某些细胞当下状态可以不选择对数期细胞。
2.推荐使用10mL培养瓶;
关于培养瓶的选择,个人理解是基于实验目的和成本同时考虑计数方便,太小不便于计数,太大实验损耗大。为排除实验耗材影响时可以使用多孔板,多条件比对时多半效率更高。
3.每瓶接种细胞总数一致,加入培养液体积一致;
细胞接种密度影响细胞的生长状态,因此需要保证接种密度相同。不同体积同样总数时贴壁效果存在差异,所以建议相同体积。
4.细胞接种数不能太多也不能太少,太少细胞滞留期太长;数量太多,细胞将很快进入平台期,需要短期内进行传代,不能反应细胞生长情况。一般接种数量以7~10天能长满而不发生生长抑制为度;
所以细胞生长曲线方法建立时需要考虑对比不同接种密度下的生长情况。
5.同种细胞的生长曲线先后测定要采用同一接种密度,以便于纵向比较;不同的细胞接种密度相同才能比较;
6.酌情每天或每隔1天取出3瓶进行计数,计算均值;一般间隔24h,连续观察1~2周或到细胞总数开始减少为止(一般需要10天);
7.培养3~5天后给细胞进行换液;
需要按照不同细胞实际确定换液频率。
8.曲线绘制,以培养时间为横轴,细胞数为纵轴(对数),描绘在半对数坐标纸上。连接成曲线后即成该细胞的生长曲线。
此处需要强调一下时对数,也就是半对数绘图。
附赠生长曲线Excel绘制方法
1)统计0~7/10天数据
2)以培养时间为横轴,细胞数为纵轴(对数),绘制散点图;
3)选择纵轴双击刻度,进入坐标轴选项;
4)选择“对数刻度”,底数为10;
5)最小值改为最小计数结果所在数量级。
6)完成图表绘制.
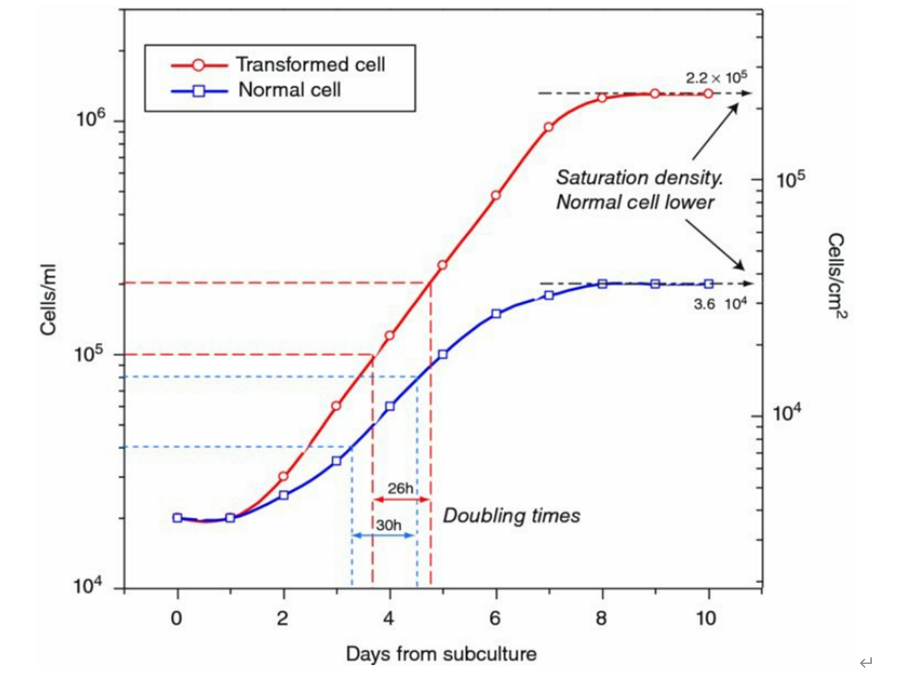
细胞生长曲线及倍增时间(图片来源于《Culture of Animal Cells A Manual of Basic Technique and Specialized Applications》,仅供学习交流用)
9.结果分析
标准的生长曲线近似S形,一般在传代后第一天细胞数有所减少,在经过几天滞留期,然后进入对数生长期。达到平台期后生长稳定,最后达到衰老。在生长曲线上细胞数量增加1倍的时间称为细胞倍增时间,可以从曲线上换算出。
细胞倍增的时间区间即对数生长期,细胞传代、实验等多应在此区间进行。
10.细胞倍增时间计算方式:
1)作图法,在细胞生长曲线的对数生长期找出细胞增加以备所需的时间(doubling time,DT);
2)公式法:按细胞倍增时间计算细胞群体倍增时间
DT=t[lg2/(lgNt-lgN0)]
t为培养时间,N0代表首次计数获得的细胞数,Nt代表培养时间为t时间后的细胞计数。
一般情况下首次计数在细胞接种24h后进行,而Nt是细胞在对数期生长终点时的细胞数。
11.其他思考
1)在细胞接种密度低是前几天会遇到计数低的情况,此时通过离心浓缩会影响计数结果,建议使用多孔培养板会出现初始计数低的情况,可以多孔混合后进行计数。也可以在细胞数量少的时候,减少胰蛋白酶用量。
2)为了避免离心损失,终止消化就进行计数,不建议离心后计数。
3)为保证细胞分布均匀,可以在加样后静置片刻再放入37℃进行培养。
4)培养板不建议叠放培养。
5)细胞生长曲线消化前注意观察细胞形态和分布,便于确认实验存在差异的原因。
6)细胞计数时避免产生气泡,其次注意取样的代表性。
7)可以适度过度消化,尽量得到单细胞悬液,但需要注意不影响细胞活率。
8)细胞生长曲线有别于细胞传代,我们需要保证计数结果准确,其次活率也有影响所以不要完全按照细胞传代进行操作,例如我们会过度消化不考虑对细胞活性的影响等。
三、小结
细胞生长曲线是基于细胞生长培养的一个简单实验。因其与细胞培养大同小异,难免不被重视,其次很多时候大家看到S形曲线就认为成功了,然而再重复时会发现各种小问题,这些小问题多是质量研究过程中影响项目进度的部分原因。
对这些问题个人进行了如下总结:
1.质量研究过程中得出的方法描述过于简洁导致新人接受程度差。很多经验丰富的质量研究员会认为很多实验注意事项就是本能不需要进行描述,然而就是这些细节导致新人踩坑。针对这种情况个人目前想到的解决方式就是输出的方法尽可能做到经过基础培训的人员即可看懂,不放过研究过程中的任何异常。
2.不同于分析方法开发,质量研究中根据研究对象不同和研究目的不同提前对方法进行更多研究,例如不同接种密度下的生长曲线是什么样的,在细胞过大时会出现什么情况,实验过程中培养基pH会发生那些变化等。质量研究人员需要对质量研究过程中的方法有更深入的了解,而不仅是确定所用方法可行有效。
3.质量研究过程中存在较多未知因素,不能在理想条件下进行实验。例如细胞生长曲线绘制时你会发现我们研究用的细胞培养体系时存在缺陷的(对大密度细胞来说营养不足、贴壁基质不稳定、研究用细胞已变异等),因此质量研究人员需要在质量研究过程中注意观察实验细节(细胞形态变化、pH值变化等),尊重事实,基于事实进行充分研究。在不断踩坑和填坑的过程中质量研究人员方能超神。
4.将质量研究看作质量控制,质量研究不同于QC,质量研究过程不仅是考虑分析方法也不仅是是否满足标准,质量研究人员需要明确自己研究目的进而决定采取的措施。在否定研究对象前,质量研究人员需要排除仪器设备人员等引入的偏离,其次结合工艺和工艺目标确认下一步策略,而不仅仅是一次检验结果的交付。
作为一个基础知识薄弱的质量研究人员,我在工作过程中感觉举步维艰,不禁感慨人生艰难。欢迎拍砖,感觉我可怜来个赞赏啊。^_^

