欢迎访问『 博普智库 』制药人必备知识工具
3130 单抗 N 糖谱测定法
第一法 亲水相互作用色谱法
本法系通过N糖苷酶F(PNGase F)对单抗N糖进行酶切,再对经酶切的N糖进行标记衍生,然后用超高效液相色谱法对单抗N糖谱进行测定。
照高效液相色谱法(通则0512)( (通则0512))测定。
(通则0512))测定。
试剂 (1)N糖苷酶F(PNGase F)。
(2)2-氨基苯甲酰胺(2-AB)标记溶液 取350μl二甲基亚二甲基亚砜(DMSO)和150μl乙酸,混匀。精密称取25mg2-AB加入上述溶液中,充分溶解。精密称取30mg氰基硼氢化钠加入上述溶液中,充分溶解(可适当加热)。
(3)系统适用性对照品。
色谱条件 用酰胺基键合硅胶填充色谱柱,柱长150mm、内径2.1mm、粒度1.7μm,或等效色谱柱;柱温为60C,供试品保存温度为2~8℃;以50mmol/L的甲酸铵溶液(pH4.5)为流动相A液、乙腈为流动相B液,按下表进行梯度洗脱60.0分钟;荧光检测器检测,检测波长:激发波长330nm、发射波长420nm、增益10。
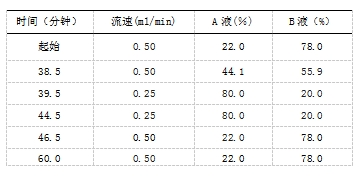
系统适用性对照品溶液的制备 (1)N糖的酶切 准备30kD的超滤离心管,加入150ul的超纯水,≥13500g 离心5分钟(舍弃残留有大体积液体的超滤管,并处理新的超滤管)加人200ul 10mg/ml的系统适用性对照品溶液至超滤管中≥13 500g,离心10分钟,丢弃下层液体。向上层截留溶液中加入400ul,10mmol/L的磷酸盐缓冲溶液(PBS,pH7.4)≥13 500g离心10分钟,重复两次,吸取全部上层截留溶液转移至离心管中。吸取1501 10mmol/L的PBS润洗上层超滤管,并转移至对应的离心管中(浓度约为 10mg/ml)。取25ul置换PBS后的溶液,加入5ul PNGaseF和70ul10mmol/L的PBS,总体积为100l,混匀并短暂离心37°C水浴下孵育20小时.
(2)蛋白去除和N糖的标记 向酶切完的溶液中加入三倍体积预冷的乙醇,涡旋混匀,-20℃放置1小时,沉淀蛋白。≥13 500g离心10分钟。吸取适量(如360μl)上清液至离心管中离心干燥。待完全干燥后,加入10μl 2-AB标记溶液,涡旋混匀并短暂离心,65℃下孵育2~4小时。
(3)标记的N糖纯化 釆用凝胶过滤或固相萃取,按照说明书进行操作,对标记的N糖进行纯化,以去除游离的2-AB,离心干燥纯化的样品,用100μl 170%乙腈溶液复溶。
供试品溶液的制备 参照本法“系统适用性对照品溶液的制备”方法进行制备。
空白对照溶液的制备 空白对照系按照制剂配方配制,但不含有单抗的溶液。参照本法“系统适用性对照品溶液的制备”方法进行制备。
测定法 分别量取制备好的系统适用性对照品溶液、供试品溶液和空白对照溶液,注入色谱仪,记录色谱图。进样量为5μl。
进样顺序:空白对照溶液(进样1针)、系统适用性对照品溶液(至少进样2针),供试品溶液1、供试品溶液2……系统适用性对照品溶液(至少进样1针)。
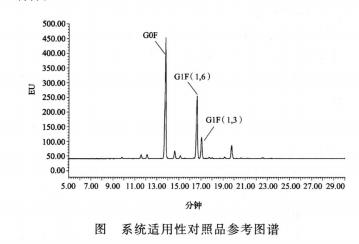
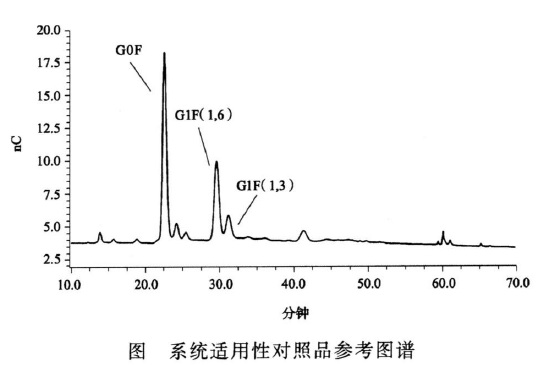
系统适用性 空白对照应无干扰峰存在,系统适用性对照品的色谱图应与参考图谱相似。
系统适用性对照品G1F(1,6)峰和G1F(1,3)峰之间的分离度不低于1.8。系统适用性对照品G0F峰面积(%)应在规定范围内(见该批次对照品说明书)。系统适用性对照品G0F峰保留时间的RSD应不高于4%(n≥3)。
结果分析 按峰面积归一化法计算,各N糖型峰面积占所有峰面积之和的百分比即为该N糖的相对百分含量。
注意事项 (1)不同品牌PNGase F的酶活性单位可能存在差异,可根据PNGase F是否能够完全酶切(如CE-SDS电泳),调节加入的酶体积和缓冲液体系与孵育时间。
(2)本方法中描述的N糖酶切步骤适用于单抗Fc上的N糖酶切;对于在Fab上存在N糖修饰的单抗,可结合免疫球蛋白G降解酶(IdeS)酶切以及变性、还原等步骤进行处理。
(3)不同品牌荧光检测器的检测波长可能存在差异,可对检测波长进行调整(如:激发波长260nm、发射波长430nm)。对于检测器增益可进行调节,以获得合适的信号响应强度。
(4)缓冲液置换、蛋白沉淀去除以及N糖的纯化等步骤,可采用其他系统进行(如固相萃取、凝胶过滤等),以达到等效的缓冲液置换、去蛋白沉淀和纯化等目的。根据供试品的蛋白浓度和不同的缓冲液置换方式,可对本法“系统适用性对照品溶液的制备”步骤(1)中需要置换缓冲液的供试品体积/蛋白量进行调节。
(5)高效液相色谱仪品牌不同,色谱柱的品牌/批号不同,系统适用性对照品的色谱图与参考图谱在峰型上可能略有差异。可根据色谱柱说明书对色谱条件进行适当调整。
(6)经评价和验证,可采用市售的试剂盒进行供试品制备。
第二法 毛细管电泳法
本法系通过N糖苷酶F(PNGase F)对单抗N糖进行酶切,再对经酶切的N糖进行标记衍生,然后用毛细管电泳法对单抗N糖谱进行测定。
照毛细管电泳法(通则0542)( (通则0542))测定。
(通则0542))测定。
毛细管电泳系统 (1)检测器激光诱导荧光检测器。激发波长:488nm,发射波长:520nm。
(2)毛细管 涂层熔融石英毛细管(内径50μm),切割至总长度60cm,有效长度50cm。
试剂 (1)N糖苷酶F(PNGase F)。
(2)8-氨基芘-1,3,6-三磺酸三钠盐(APTS)标记溶液精密称取5mg APTS,加入100μl 15%的醋酸溶液溶解,避免光照。
(3)1mol/L氰基硼氢化钠-四氢呋喃(THF)溶液。
(4)系统适用性对照品。
(5)分离缓冲液 含40mmol/L 6-氨基己酸和0.2%(W/V)羟丙基甲基纤维素的水溶液,pH4.5。
系统适用性对照品溶液的制备 (1)N糖的酶切 准备30kD的超滤离心管,加入150μl的超纯水,≥13 500g离心5分钟(舍弃残留有大体积液体的超滤管,并处理新的超滤管)。加入200μl 10mg/ml的系统适用性对照品溶液至超滤管中,≥13 500g离心10分钟,丢弃下层液体。向上层截留溶液中加入400μl 10mmol/L的PBS(pH7.4)缓冲液,≥13 500g离心10分钟,重复两次,吸取全部上层截留溶液转移至离心管中。吸取150μl 10mmol/L的PBS润洗上层超滤管,并转移至对应的离心管中(浓度约为10mg/ml)。取25μl置换PBS后的溶液,加入5μl PNGase F和70μl 10mmol/L的PBS,总体积为100μl,涡旋混匀并短暂离心,37℃水浴下孵育20小时。
(2)蛋白去除和N糖的标记 向酶切完的溶液中加入三倍体积预冷的乙醇,涡旋混匀,-20℃放置1小时,沉淀蛋白。>13 500g离心10分钟。吸取适量(如360μl)上清液至离心管中离心干燥。待完全干燥后,加入15μl APTS标记溶液和5μl 1mol/L氰基硼氢化钠-THF,混匀并短暂离心,55℃下孵育4小时。加入500μl 水淬灭标记反应并涡旋混匀,取岀适量的溶液至样品管中进行分析。
供试品溶液的制备 参照本法“系统适用性对照品溶液的制备”方法进行制备。
空白对照溶液的制备 空白对照系按照制剂配方配制,但不含有单抗的溶液。参照本法“系统适用性对照品溶液的制备”方法进行制备。
测定法 分离缓冲液在50psi压力下冲洗4分钟,以0.2psi压力进样纯水5秒,以0.5psi压力进样供试品10秒,29kV下分离20分钟(反相极性)。
毛细管温度:20℃。
样品盘温度:20℃。
进样顺序:空白对照溶液(进样1针)、系统适用性对照品溶液(至少进样2针),供试品溶液1、供试品溶液2……系统适用性对照品溶液(至少进样1针)。
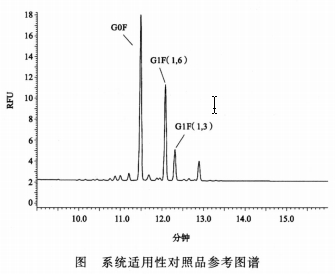
系统适用性 空白对照应无干扰峰存在,系统适用性对照品的色谱图应与参考图谱相似。
系统适用性对照品G1F(1,6)和G1F(1,3)峰之间的分离度不低于2.0。系统适用性对照品G0F修正峰面积(%)应在规定范围内(见该批次对照品说明书)。系统适用性对照品G0F峰保留时间的RSD应不高于4%(n≥3)。
结果分析 按峰面积归一化法计算,各N糖型修正峰面积占所有修正峰面积之和的百分比即为该N糖的相对百分含量。
注意事项 (1)不同品牌PNGase F的酶活性单位可能存在差异,可根据PNGase F是否能够完全酶切(如CE-SDS电泳),调节加入的酶体积和缓冲液体系与孵育时间。
(2)本方法中描述的N糖酶切步骤适用于单抗Fc上的N糖酶切;对于在Fab上存在N糖修饰的单抗,可结合免疫球蛋白G降解酶(IdeS)酶切以及变性、还原等步骤进行处理。
(3)缓冲液置换、蛋白沉淀去除等步骤,可采用其他系统进行(如固相萃取、凝胶过滤等),以达到等效的缓冲液置换、去蛋白沉淀和纯化等目的。根据供试品的蛋白浓度和不同的缓冲液置换方式,可对本法“系统适用性对照品溶液的制备'步骤(1)中需要置换缓冲液的供试品体积/蛋白量进行调节。
(4)毛细管电泳仪品牌不同,毛细管的品牌/批号不同,系统适用性对照品的色谱图与参考图谱在峰型上可能略有差异。可对电泳条件进行适当调整。
(5)经评价和验证,可采用市售的试剂盒进行供试品制备。
第三法高效阴离子色谱法
本法系通过N糖昔酶F(PNGase F)对单抗N糖进行酶切,然后用高效阴离子色谱法对单抗 N糖谱进行测定。
照离子色谱法(通则0513)( (通则0513))测定
(通则0513))测定
试剂 (1)N糖苷酶F(PNGase F)。
(2)系统适用性对照品。
色谱条件 用固定相为键合季铵功能基的乙基乙烯基苯-二乙烯基苯共聚物,柱长250mm、直径3mm、粒度5.5um或等效色谱柱;柱温为 30C,供试品保存温度为2~8C;以50mmol/L的氢氧化钠(NaOH)溶液为流动相A液,以含50mmol/L NaOH和250mmol/L醋酸钠的水溶液为流动相B液,流速为每分钟0.5ml,按下表进行梯度洗脱90.0分钟。
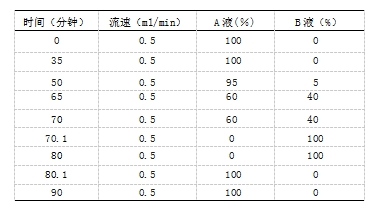
脉冲安培检测器,Au工作电极(推荐使用1mm直径)Ag/AgCI参比电极、合金对电极,四电位检测波形(电位见下表)进行检测。

系统适用性对照品溶液的制备
(1)N糖的酶切 准备30kD的超滤离心管,加人150ul的超纯水,>13 500g 离心5分钟(舍弃残留有大体积液体的超滤管,并处理新的超滤管)。加入200ul 10mg/ml的系统适用性对照品溶液至超滤管中,>13 500g 离心 10 分钟,丢弃下层液体。向上层截留溶液中加入400ul 10mmol/L的PBS(pH7.4)缓冲液,13500g离心10分钟,重复两次,吸取全部上层截留溶液转移至离心管中。吸取150ul10mmol/L的PBS润洗上层超滤管,并转移至对应的离心管中(浓度约为 10mg/ml)。取50ul置换PBS后的溶液,加入5ul PNGaseF和45ul10mmol/I的PBS,总体积为100ul,混匀并短暂离心,37C水浴下孵育20小时。
(2)蛋白去除 向酶切完的溶液中加入三倍体积预冷的乙醇,涡旋混匀,-20℃放置1小时,沉淀蛋白。≥13 500g离心10分钟。吸取适量(如360μl)上清液至离心管中离心干燥。待完全干燥后,用100μl 0.1%三氟乙酸溶液复溶干燥后的系统适用性对照品。
(3)N糖纯化 采用凝胶过滤或固相萃取,按照说明书进行操作,对N糖进行纯化。离心干燥纯化的系统适用性对照品,用1ml纯水复溶。
供试品溶液的制备 参照本法“系统适用性对照品溶液的制备”方法进行制备。
空白对照溶液的制备 空白对照系按照制剂配方配制,但不含有单抗的溶液。参照本法“系统适用性对照品溶液的制备”方法进行制备。
测定法 分别量取制备好的系统适用性对照品溶液、供试品溶液和空白对照溶液,注入色谱仪,记录色谱图。进样量为50μl。
进样顺序:空白对照溶液(进样1针)、系统适用性对照品溶液(至少进样2针),供试品溶液1、供试品溶液2……系统适用性对照品溶液(至少进样1针)。 系统适用性 空白对照应无扰峰存在,系统适用性对照品的色谱图应与参考图谱相似。
系统适用性对照品 G1F(1,6)和G1F(1,3)峰之间的分离度不低于1.0。系统适用性对照品G0F峰面积(%)应在规定范围内(见该批次对照品说明书)。系统适用性对照品G0F峰保留时间的RSD应不高于4%(n≥3)。
结果分析 按峰面积归一化法计算,各N糖型峰面积占所有峰面积之和的百分比即为该N糖的相对百分含量。
注意事项 (1)不同品牌PNGase F的酶活性单位可能存在差异,可根据PNGase F是否能够完全酶切(如CE-SDS电泳),调节加入的酶体积和缓冲液体系与孵育时间。
(2)本方法中描述的N糖酶切步骤适用于单抗Fc上的N糖酶切;对于在Fab上存在N糖修饰的单抗,可结合免疫球蛋白G降解酶(IdeS)酶切以及变性、还原等步骤进行处理。
(3)不同品牌检测器可能存在差异,可对检测器参数(电位电压等)进行适当调整,以获得合适的信号响应强度。
(4)缓冲液置换、蛋白沉淀去除以及N糖的纯化等步骤,可釆用其他系统进行(如固相萃取、凝胶过滤等),以达到等效的缓冲液置换、去蛋白沉淀和纯化等目的。根据供试品的蛋白浓度和不同的缓冲液置换方式,可对本法“系统适用性对照品溶液的制备”步骤(1)中需要置换缓冲液的供试品体积/蛋白量进行调节。
(5)离子色谱仪品牌不同,色谱柱的品牌/批号不同,系统适用性对照品的色谱图与参考图谱在峰型上可能略有差异。可根据色谱柱说明书对色谱条件进行适当调整。
继续阅读
在线查询结果来源于2020年版中国药典,仅供参考。由专业团队进行审核校对。

